��Ŀ����
����Ŀ��������������������ܵ��Ƿ�©���ķ�ӦΪ��3Cl2+8NH3��N2+6NH4Cl��
��1���ڸ÷�Ӧ�У�����ԭ��Ԫ��������Ϊ��ԭ���������� ��
��2���ڷ���ʽ�ϱ������ת�Ƶķ������Ŀ��
��3������״������33.6LCl2�μӷ�Ӧ����������NH3�����ʵ���Ϊmol��
��4����֪������������ʱ����Ӧ������N2��HCl����ij�η�Ӧ���ò����У�NH4Cl��HCl�����ʵ�����ȣ���μӷ�Ӧ��Cl2��NH3�����ʵ���֮��Ϊ ��
���𰸡�
��1��Cl��NH3
��2��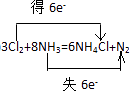
��3��1
��4��3��5
���������⣺��1����Ӧ��NԪ�ػ��ϼ����ߣ���Ϊ��ԭ����������N2Ϊ�������ClԪ�ػ��ϼ۽��ͣ�Cl2Ϊ����������ԭ�����Դ��ǣ�Cl��NH3����2����Ӧ��NԪ�صĻ��ϼ��ɩ�3����Ϊ0��ClԪ�صĻ��ϼ�0����Ϊ��1�ۣ�2molNH3����ԭ��ת�Ƶ���Ϊ6mol����Ӧ����ת�Ƶķ������ĿΪ  �����Դ��ǣ�
�����Դ��ǣ�  ����3���ɷ���ʽ��֪������3molCl2�μӷ�Ӧʱ����2molNH3����������33.6LCl2�����ʵ���Ϊ1.5mol�����Ա�������NH3�����ʵ���Ϊ
����3���ɷ���ʽ��֪������3molCl2�μӷ�Ӧʱ����2molNH3����������33.6LCl2�����ʵ���Ϊ1.5mol�����Ա�������NH3�����ʵ���Ϊ ![]() mol=1mol�����Դ��ǣ�1����4���������֪��ӦΪ��3Cl2+5NH3=N2+3NH4Cl+3HCl�����Բμӷ�Ӧ��Cl2��NH3�����ʵ���֮��Ϊ3��5�����Դ��ǣ�3��5��
mol=1mol�����Դ��ǣ�1����4���������֪��ӦΪ��3Cl2+5NH3=N2+3NH4Cl+3HCl�����Բμӷ�Ӧ��Cl2��NH3�����ʵ���֮��Ϊ3��5�����Դ��ǣ�3��5��

����Ŀ����ΪԪ�����ڱ���һ���֣���Ԫ�ط��Ż�ѧ����ش��������⣮
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | ||
4 | �� | �� |
��1��10��Ԫ���У���ѧ��������õ��� �� ������ԭ�Ӱ뾶������
��2���١��ڡ��ܡ�������Ԫ���γɵ����Ӱ뾶�ɴ�С��˳��Ϊ
��3����̬�Ģ��γɵĻ�����ĵ���ʽ�� �� �١�������Ԫ�����γɺ����ۼ������ӻ�����û�����ĵ���ʽΪ���õ���ʽ��ʾԪ�آۺ͢��γɻ�����Ĺ���
��4���ޡ�������Ԫ���γɵļ��⻯���У��е�ߵ��� �� ԭ����
��5���ܺ͢�����Ԫ������������Ӧˮ�������Ӧ�����ӷ���ʽ
��6��д��һ���ܱ�ʾ�ߡ�������Ԫ�طǽ�����ǿ����ϵ�Ļ�ѧ����ʽ
��7�����������У��϶�a������b����������ǿ����������ţ�
A.aԭ�ӵ�������������bԭ�ӵ�������������
B.aԭ�ӵĵ��Ӳ�����bԭ�ӵĵ��Ӳ�����
C.1mol a �������û�H+���ɵ�H2��1mol b�������û�H+���ɵ�H2��
D.����ʱ��a�ܴ�ˮ���û����⣬��b���ܣ�