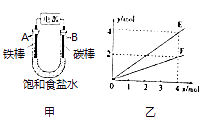
题目内容
【题目】R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入01mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( ) 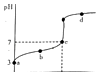
A.a点表示溶液中c(CH3COO﹣)﹣定为10﹣3 mol/L
B.b点表示的溶液中c(Na+)<c(CH3COO﹣)
C.c点表示CH3COOH和NaOH恰好反应完全
D.d点表示的溶液中 ![]() 大于K
大于K
【答案】B
【解析】解:A.a点是c(H+)=10﹣3mol/L,由于醋酸为弱酸,酸能抑制水的电离,醋酸的电离远远大于水的电离,所以溶液中氢离子浓度近似等于醋酸根离子浓度,大约为10﹣3 mol/L,故A错误;B.溶液满足c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣),b点时,c(H+)>c(OH﹣),则有c(CH3COO﹣)>c(Na+),故B正确;
C、醋酸和氢氧化钠反应生成醋酸钠,醋酸钠是强碱弱酸盐其水溶液呈碱性,当酸碱恰好反应时溶液应该呈碱性,但C点溶液呈中性,说明酸过量,故C错误;
D、d点溶液的温度相同,所以d点表示的溶液中 ![]() 等于K,故D错误;
等于K,故D错误;
故选B.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: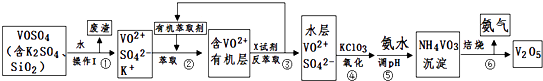
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+ , HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 .
③中X试剂为 .
(3)④的离子方程式为 .
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 . 若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< . (已知:25℃时,Ksp[Fe(OH)3]=2.6×10﹣39)
(5)该工艺流程中,可以循环利用的物质有和 .
【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,则现象及结论都正确的是( )
操作 | 现象 | 结论 | |
A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42﹣ |
B | 滴加氯水和CCl4 , 振荡、静置 | 上层溶液显橙红色 | 原溶液中有Br﹣ |
C | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈紫色 | 原溶液中有K+ |
D | 滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
A.A
B.B
C.C
D.D
【题目】2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____________________。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:_____________

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ.
①该反应的热化学方程式为______________________________________________
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为___________________________________________________。(已知:H2S: ![]() ;
; ![]() ;H2CO3:
;H2CO3: ![]() ;
; ![]() )
)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | 0 | ||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是__________。
③该反应的△H ______0(填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时v正___________v逆(填“<”,“>”,“=”)。