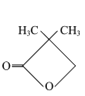
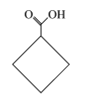
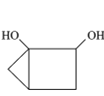
题目内容
【题目】某电化学装置如图所示(电极a、b均为碳棒)。
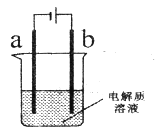
(1)烧杯中盛有饱和NaCl溶液,往烧杯中加几滴酚酞试液,通电发生反应。则电解总反应方程式为_____________。电极a上及附近溶液中的实验现象为_____________。
(2)若烧杯中盛有200mL 0.1mol/L CuSO4溶液。通电反应一段时间,在两极收集到的气体体积相等,则此段时间e-转移的物质的量为_________mol。
【答案】2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 电极a上产生无色气泡,电极附近溶液变红 0.08
Cl2↑+H2↑+2OH- 电极a上产生无色气泡,电极附近溶液变红 0.08
【解析】
(1)电解氯化钠溶液时阳极氯离子放电生成氯气,阴极氢离子放电生成氢气,电解总反应方程式为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;a极与电源负极相连为阴极,阴极氢离子放电生成氢气,会有气泡产生,同时破坏水的电离平衡,使水的电离平衡右移,氢氧根浓度变大,阴极附近显碱性,遇酚酞会变红;
Cl2↑+H2↑+2OH-;a极与电源负极相连为阴极,阴极氢离子放电生成氢气,会有气泡产生,同时破坏水的电离平衡,使水的电离平衡右移,氢氧根浓度变大,阴极附近显碱性,遇酚酞会变红;
(2)电解硫酸铜溶液,开始时阴极反应为Cu2++2e-=Cu,,当铜离子完全反应后发生2H++2e-=H2↑,阳极的反应一直为4OH--4e-=O2↑+2H2O,设最终收集的到氧气的物质的量为a,两极收集到的气体体积相等,则收集到的氢气的物质的量也为a,溶液中铜离子的物质的量为0.2L×0.1mol/L=0.02mol,根据电子守恒可知4a=2a+0.02mol×2,解得a=0.02mol,即生成的氧气为0.02mol,转移电子的物质的量为0.08mol。

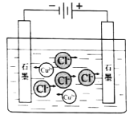
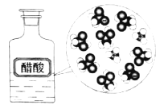
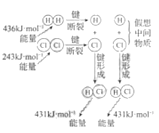
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
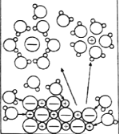
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
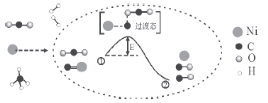
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D