题目内容
【题目】(18分)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
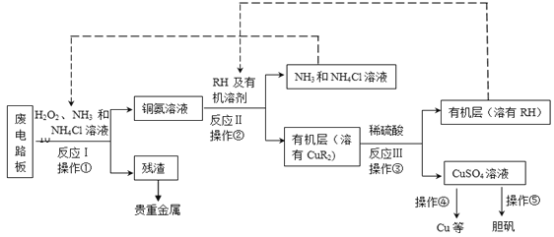
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,反应中H2O2的作用是 。写出操作①的名称: 。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,写出该反应的离子方程式: 。操作②用到的主要仪器名称为 ,其目的是(填序号) 。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度
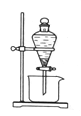
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和 。若操作③使用下图装置,图中存在的错误是 。
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是 。操作⑤由硫酸铜溶液制胆矾的主要步骤是 。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是 。循环使用的NH4Cl在反应Ⅰ中的主要作用是 。
【答案】(1)作氧化剂 过滤
(2)Cu(NH3)42++2RH=2NH4++2NH3+CuR2分液漏斗 a b
(3)RH 分液漏斗尖端未紧靠烧杯内壁 液体过多
(4)O2H2SO4加热浓缩 冷却结晶 过滤
(5)H2SO4防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀
【解析】
试题(1)废电路板中加入双氧水、氨气、氯化铵溶液,得到铜氨溶液和残渣,分离难溶性固体和溶液采用过滤的方法,所以操作①为过滤。反应Ⅰ是将铜转化为铜氨溶液,铜元素的化合价升高,所以铜是还原剂,则双氧水为氧化剂,将铜氧化。(2)反应Ⅱ是铜氨溶液中的铜氨离子与有机物RH反应,生成CuR2,同时生成NH4+和 NH3,方程式为:Cu(NH3)42++2RH=2NH4++2NH3+CuR2。分液的目的是富集铜元素,使铜元素与水溶液中的物质分离,所以a b正确。(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应相当于复分解反应,所以生成硫酸铜和RH。互不相溶的液体采用分液的方法,分液时分液漏斗下端要紧靠烧杯内壁,且分液漏斗内部不能盛放太多溶液。(4)以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,所以阳极上产生O2,同时有大量的氢离子生成,且硫酸根离子也向阳极移动在阳极积累,因此阳极产物还有硫酸,从溶液中获取晶体加热浓缩 冷却结晶 过滤的方法。(5)电解硫酸铜溶液时得到硫酸,在反应Ⅲ中用到的H2SO4所以硫酸能循环使用。氯化铵电离出的铵根离子抑制一水合氨的电离,从而降低溶液的碱性, 防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀

 阅读快车系列答案
阅读快车系列答案【题目】某化学小组采用类似制乙酸乙酯的装置![]() 如下图
如下图![]() 以环己醇为原料制备环己烯。
以环己醇为原料制备环己烯。

已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是_________。
②试管C置于冰水浴中的目的是________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在____层(填“上”或“下”),分液后用________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________________。

③收集产品时,控制的温度应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点