题目内容
【题目】短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,B为地壳中含量最多的元素,C是原子半径最大的短周期主族元素,C与D形成的离子化合物CD是常用的调味品。填写下列空白:
(1)AB2的结构式_______________;C元素在周期表中的位置是_____________
(2)B、C组成的一种化合物与水发生化合反应的化学方程式为:____________________
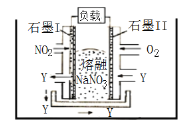
(3)如图所示,电解质a溶液为含有CD的饱和溶液。X为石墨电极,Y为铁电极,接通直流电源。
X电极的电极反应式为________________________。
Y电极的电极反应式为________________________。
(4)常温下,相同体积的0.2mol·L—1CD溶液与0.1mol·L—1 C2AB3溶液中,总离子数目较多的是______________溶液(填化学式)。
【答案】O=C=O 第三周期IA族 Na2O + H2O == 2NaOH 2H+ + 2e-= H2↑(或2H2O + 2e-= H2↑+ 2OH-) Fe—2e-= Fe2+ NaCl
【解析】
短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,最外层最多含有8个电子,则A含有2个电子层,最外层含有4个电子,为C元素;B为地壳中含量最多的元素,则B为O元素;C是原子半径最大的短周期主族元素,则C为Na元素;C与D形成的离子化合物CD是常用的调味品,CD为NaCl,则D为Cl元素,据此解答。
根据分析可知,A为C元素、B为O元素、C为Na元素、D为Cl元素。
(1)A B2为CO2,CO2中碳最外层4个电子,分别与O形成两个共价键,CO2的结构式为O=C=O;C元素为Na元素,在周期表中的位置第3周期第IA族;
故答案为:O=C=O;第三周期IA族;
(2)B、C组成的一种化合物与水发生化合反应,该化合物为Na2O,发生反应为:Na2O+H2O═2NaOH;
(3)电解NaCl的饱和溶液,X为石墨电极,与电源负极相连,作阴极;X电极的电极反应式为:![]() (或
(或![]() );Y为铁电极,与直流电源正极相连,作阳极,发生氧化反应,Y电极的电极反应式为:
);Y为铁电极,与直流电源正极相连,作阳极,发生氧化反应,Y电极的电极反应式为:![]() ;
;
故答案为:![]() (或
(或![]() );
);![]() ;
;
(4)常温下,相同体积的0.2molL1NaCl溶液与0.1molL1Na2CO3溶液中,c(Na+)相同,都是0.2mol/L,其中NaCl溶液中c(Cl)=0.2mol/L,Na2CO3溶液中,由于水解程度较小,阴离子浓度接近0.1mol/L,根据![]() 可知NaCl溶液中总离子数目较多;
可知NaCl溶液中总离子数目较多;
故答案为:NaCl。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
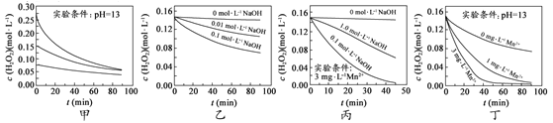
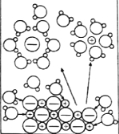
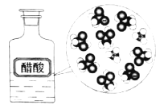
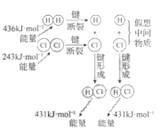
新黄冈兵法密卷系列答案【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D