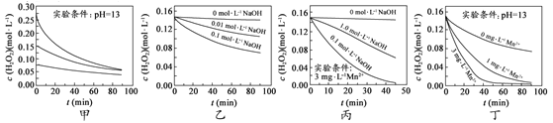
题目内容
【题目】N2O5在一定温度下可发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是( )
A.500s内NO2的生成速率为2.96×10-3mol/(L·s)
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.平衡后,其他条件不变,将容器体积变为原来的![]() ,则c(N2O5)<5.00mol/L
,则c(N2O5)<5.00mol/L
D.T1、T2温度下的平衡常数分别为K1、K2,若T1>T2,则K1>K2
【答案】D
【解析】
由表中数据可知,T1温度时,向密闭容器中通入N2O5气体, 500s之前未达平衡,1000s后已达平衡。在此认识基础上,根据该反应的特点及题给数据,可对各选项作出判断。
A. 500s内NO2的生成速率为(5.00-3.52) mol·L-1÷500s×2=5.92×10-3mol/(L·s),A选项错误;
B. T1温度下该反应平衡时N2O5的浓度为2.50mol/L,转化率为(5.00-2.50) mol·L-1÷5.00mol/L=50%,B选项错误;
C. 平衡后,其他条件不变,将容器体积变为原来的![]() ,平衡向逆向移动,则c(N2O5)>2×2.50mol/L=5.00mol/L,C选项错误;
,平衡向逆向移动,则c(N2O5)>2×2.50mol/L=5.00mol/L,C选项错误;
D. 该反应ΔH>0,为吸热反应,升高温度,平衡常数增大,所以,若T1、T2温度下的平衡常数分别为K1、K2,且T1>T2,则K1>K2,D选项正确;
答案选D。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案【题目】取体积均为1 L的四组X的溶液进行实验(X受热发生分解反应),在不同温度下测得X的物质的量(mol)随时间的变化如下表所示。下列说法不正确的是
| 0 min | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min | |
① | 10°C | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
② | 10°C | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
③ | 25°C | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
④ | 30°C | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A.在0~10 min内,实验③④中X的转化率相同
B.实验②中改变的条件可能是加入催化剂
C.在10~20 min内,实验①中X的平均分解速率为0.01 mol L-1min-1
D.对比实验①和④,能说明X的反应速率随温度升高而增大
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶性杂质)回收铜和铬等金属,回收流程如图所示:

已知部分物质沉淀的pH(如表)及CaSO4元的溶解度曲线(如图):
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀 | 2.1 | 4.7 | 4.3 |
完全沉淀 | 3.2 | 6.7 | 5.6 |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_____________(填化学式)。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到______;
②将浊液加热到80℃,____________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子方程式:_________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是______________。