题目内容
7.阿伏加德罗常数用NA表示,下列叙述正确的是( )①22gT2O含有电子数为10NA
②0.44gC3H8中含有的σ键总数目为0.1NA
③1mol Na2O2与CO2完全反应时转移电子数为2NA
④28g 硅晶体中含有2NA个Si-Si键
⑤11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑥200mL,1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子数的总和是NA
⑦在常温常压下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数为0.3NA
⑧O2和O3的混合物共6.4g,其中所含原子数一定为0.4NA.
| A. | ①②③⑤⑧ | B. | ②④⑥⑦⑧ | C. | ①③⑤⑥⑦ | D. | ①②④⑧ |
分析 ①T2O的摩尔质量为22g/mol,求出22gT2O的物质的量,然后根据1molT2O含有10mol电子来分析;
②求出0.44gC3H8的物质的量,然后根据1mol丙烷中含10molσ键来分析;
③Na2O2与CO2的反应为歧化反应;
④硅晶体中,每个硅原子与其他的4个Si形成4个Si-Si键,根据均摊法计算出1mol硅形成的Si-Si数目;
⑤11.2LCl2所处的状态不明确;
⑥Al3+是弱碱阳离子,在溶液中会水解;
⑦0.1mol铁与0.1mol Cl2反应时,铁过量;
⑧O2和O3的均由氧原子构成.
解答 解:①T2O的摩尔质量为22g/mol,故22gT2O的物质的量为1mol,而1molT2O含有10mol电子,即10NA个,故①正确;
②0.44gC3H8的物质的量n=$\frac{0.44g}{44g/mol}$=0.01mol,而1mol丙烷中含10molσ键,故0.01mol丙烷中含0.1molσ键,即0.1NA个,故②正确;
③Na2O2与CO2的反应为歧化反应,1mol过氧化钠转移1mol电子,即NA个,故③错误;
④28g硅晶体中含有1molSi原子,晶体硅中,每个硅原子与其它4个Si形成4个Si-Si键,则每个硅原子形成的共价键为:$\frac{1}{2}$×4=2,则1mol单质硅含有2molSi-Si键,含有2NA个Si-Si键,故④正确;
⑤11.2LCl2所处的状态不明确,不一定是标况下,其物质的量不一定是0.5mol,故⑤错误;
⑥Al3+是弱碱阳离子,在溶液中会水解导致其个数减少,故溶液中的Al3+和SO42-离子数的总和小于NA,故⑥错误;
⑦0.1mol铁与0.1mol Cl2反应时,铁过量,应根据氯气的量来计算转移的电子的数目,由于反应后氯元素变为-1价,故0.1mol氯气转移0.2mol电子即0.2NA个,故⑦错误;
⑧O2和O3的均由氧原子构成,故只要O2和O3的混合物共6.4g,无论两者的比例如何,其含有的氧原子的物质的量n=$\frac{6.4g}{16g/mol}$=0.4mol,即为0.4NA个,故⑧正确.
故选D.
点评 本题考查了物质的量以及阿伏伽德罗常数的有关计算,熟练掌握公式的使用以及物质的结构特点是解题关键,难度不大.

 口算能手系列答案
口算能手系列答案| A. | 钾和水反应:2K+2H2O=2K++2OH-+H2↑ | |
| B. | 氯化铝溶液加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| C. | 将Cl2通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++2OHˉ+Cu2++SO42ˉ=BaSO4↓+Cu(OH)2↓ |
| A. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水5mL,反应温度10℃ | |
| B. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度10℃ | |
| C. | 0.1 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ | |
| D. | 0.2 mol•L-1Na2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ |
| A. | 分子的立体结构为正四面体 | B. | 碳原子以sp3杂化 | ||
| C. | 属于极性分子 | D. | 有手性异构体 |
| A. | 原子半径:A>B>D>C | B. | 原子的最外层电子数目:A>B>D>C | ||
| C. | 原子序数:d>c>b>a | D. | 离子半径:C2->D->B+>A2+ |
| A. | 配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶 | |
| B. | 用加热法可以分离KMnO4和碘单质的混合物 | |
| C. | 经氯气消毒的自来水,若用于配制Na2CO3溶液和FeSO4溶液均会使所配溶液变质 | |
| D. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>Hg
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤元素的非金属性越强,其氧化物对应的水化物的酸性就越强
⑥已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ.mol-1则H2的燃烧热为285.8 kJ.mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A. | 只有③⑤⑦ | B. | 只有①⑥⑦ | C. | 只有②③④ | D. | 只有②④⑥ |
| A. | 在化合物中呈+2价 | B. | 单质能与水反应产生氢气 | ||
| C. | 氢氧化物为弱碱 | D. | 碳酸盐难溶于水 |
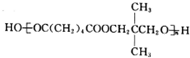
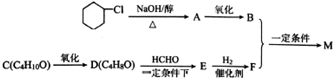
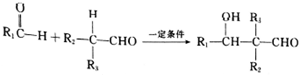
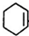 +Br2→
+Br2→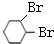 .
.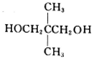 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$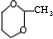 或
或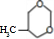 .
.