题目内容
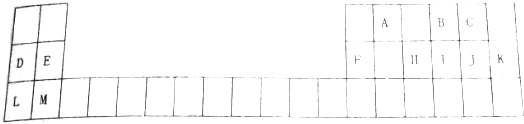
16.下列叙述正确的是( )①热稳定性:H2O>HF>H2S
②熔点:Al>Na>Hg
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤元素的非金属性越强,其氧化物对应的水化物的酸性就越强
⑥已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ.mol-1则H2的燃烧热为285.8 kJ.mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A. | 只有③⑤⑦ | B. | 只有①⑥⑦ | C. | 只有②③④ | D. | 只有②④⑥ |
分析 ①元素的非金属性越强,对应的氢化物越稳定;
②根据金属晶体的原子半径和价电子判断;
③ⅠA、ⅡA族元素的阳离子比同周期稀有气体元素少一个电子层;
④ⅢB族到ⅡB族为过渡金属元素;
⑤应为最高价氧化物的水化物;
⑥根据燃烧热的定义判断;
⑦非金属性是指气态原子得电子的能力.
解答 解:①非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,应为HF>H2O>H2S,故错误;
②原子半径Hg>Na>Al,Al的价电子数为3,Na熔沸点、硬度较小,Hg常温下为液体,故正确;
③ⅠA、ⅡA族元素的阳离子比同周期稀有气体元素少一个电子层,H+原子核外无电子,故错误;
④ⅢB族到ⅡB族为过渡金属元素,故正确;
⑤元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故错误;
⑥燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,由此可知H2的燃烧热为285.8 kJ.mol-1,故正确;
⑦非金属性是指气态原子得电子的能力,而单质存在共价键,决定单质的活泼性,故错误.
故选D.
点评 本题多角度考查元素周期表与周期律知识,为高考常见题型和高频考点,侧重于基础知识的综合理解与运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
11.有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池.该电池中反应的化学方程式:CH4+2O2+2KOH═K2CO3+3H2O,则关于此燃料电池的下列说法正确的是(一个电子带电量为1.6×10-19 C)( )
| A. | 通入甲烷的电极为电池的正极,通入氧气的电极为负极 | |
| B. | 在标准状况下,每消耗5.6 L O2,可向外提供8.3×104 C的电量 | |
| C. | 通入甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 放电一段时间后,溶液pH升高 |
1.下列反应,既是氧化还原反应又是离子反应的是( )
| A. | 炭在氧气中燃烧 | B. | 二氧化碳通入澄清石灰水中 | ||
| C. | 氯化钠溶液中滴入硝酸银溶液 | D. | 锌粒投入硫酸中 |
8.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
| A. | 2NaBr+Cl2═2NaCl+Br2 | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 3S+6KOH═2K2S+K2SO3+3H2O | |
| D. | NH4Cl+NaNO2═NaCl+N2↑+2H2O |
5.下列说法不正确的是( )
| A. | 煤和石油都是混合物 | |
| B. | 石油通过催化重整可获得环状烃 | |
| C. | 煤的干馏和石油的分馏发生的都是化学变化 | |
| D. | 用溴的四氯化碳溶液可鉴别分馏获得的汽油和裂化获得的汽油 |
6. 如图所示的两个电化学装置,图1中铜电极上产生大量的无色气泡;图2中铜电极上无气体产生,而铬电极上产生大量的有色气体.根据上述现象判断下列说法不正确的是( )
如图所示的两个电化学装置,图1中铜电极上产生大量的无色气泡;图2中铜电极上无气体产生,而铬电极上产生大量的有色气体.根据上述现象判断下列说法不正确的是( )
 如图所示的两个电化学装置,图1中铜电极上产生大量的无色气泡;图2中铜电极上无气体产生,而铬电极上产生大量的有色气体.根据上述现象判断下列说法不正确的是( )
如图所示的两个电化学装置,图1中铜电极上产生大量的无色气泡;图2中铜电极上无气体产生,而铬电极上产生大量的有色气体.根据上述现象判断下列说法不正确的是( )| A. | 图1中Cr为正极,Cu为负极 | |
| B. | 图2中Cu电极上发生的离子方程式为:Cu-2e-═Cu2+ | |
| C. | 金属铬的活泼性比铜强且能和硫酸反应生成H2 | |
| D. | 金属铬易被稀硝酸钝化 |
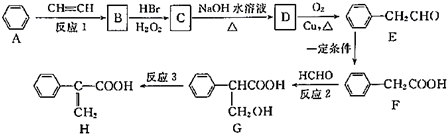
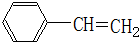 .
. .
.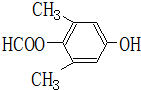 、
、 .
.