题目内容
17.镭(Ra)位于周期表的第七周期第ⅡA族,下列关于镭的性质的描述不正确的是( )| A. | 在化合物中呈+2价 | B. | 单质能与水反应产生氢气 | ||
| C. | 氢氧化物为弱碱 | D. | 碳酸盐难溶于水 |
分析 该物质位于第七周期第IIA族,和Ca同一主族,与Ca的性质具有相似性,在化合物中呈现+2价、其单质的还原性比Ca强,碱土金属的碳酸盐难溶于水,据此分析解答.
解答 解:A.主族元素最高正化合价与去族序数相等,但O、F元素除外,Ra位于第IIA族,所以在化合物中呈现+2价,故A正确;
B.元素的金属性越强,其单质与水或酸越容易,金属性Ra>Ca,钙和水反应生成氢气,则镭和水反应也能生成氢气,且比钙反应剧烈,故B正确;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Ra>Ca,所以氢氧化镭是强碱,故C错误;
D.碱土金属碳酸盐都难溶于水,所以碳酸镭难溶于水,故D正确;
故选C.
点评 本题考查元素周期律,明确同一主族元素性质的相似性及递变性是解本题关键,熟记碱土金属族元素性质递变规律,题目难度不大.

练习册系列答案
相关题目
8.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
| A. | 2NaBr+Cl2═2NaCl+Br2 | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 3S+6KOH═2K2S+K2SO3+3H2O | |
| D. | NH4Cl+NaNO2═NaCl+N2↑+2H2O |
5.下列说法不正确的是( )
| A. | 煤和石油都是混合物 | |
| B. | 石油通过催化重整可获得环状烃 | |
| C. | 煤的干馏和石油的分馏发生的都是化学变化 | |
| D. | 用溴的四氯化碳溶液可鉴别分馏获得的汽油和裂化获得的汽油 |
12.X、Y、Z、W为四种短周期主族元素.其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法不正确的是( )
| A. | Y元素最高价氧化物对应水化物的化学式为HYO4 | |
| B. | 原子半径由小到大的顺序为W<X<Z | |
| C. | X与W可形成W2X、W2X2两种物质 | |
| D. | Y2与W2在冷暗处爆炸 |
2.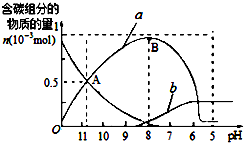 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | Na2CO3溶液中c(Na+)═2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| B. | a、b曲线分别代表的是HCO3-、H2CO3量的变化情况 | |
| C. | A点时:c(Na+)>c(CO32-)═c(HCO3-)>c(H+)>c(OH-) | |
| D. | B点时加入盐酸的体积为10mL,两者恰好完全反应生成NaHCO3 |
9.下列有关表示正确的是( )
| A. | 氯化氢分子的电子式: | B. | 氯离子的结构示意图: | ||
| C. | 乙烯分子的结构式:CH2=CH2 | D. | 苯分子的比例模型: |
6. 如图所示的两个电化学装置,图1中铜电极上产生大量的无色气泡;图2中铜电极上无气体产生,而铬电极上产生大量的有色气体.根据上述现象判断下列说法不正确的是( )
如图所示的两个电化学装置,图1中铜电极上产生大量的无色气泡;图2中铜电极上无气体产生,而铬电极上产生大量的有色气体.根据上述现象判断下列说法不正确的是( )
 如图所示的两个电化学装置,图1中铜电极上产生大量的无色气泡;图2中铜电极上无气体产生,而铬电极上产生大量的有色气体.根据上述现象判断下列说法不正确的是( )
如图所示的两个电化学装置,图1中铜电极上产生大量的无色气泡;图2中铜电极上无气体产生,而铬电极上产生大量的有色气体.根据上述现象判断下列说法不正确的是( )| A. | 图1中Cr为正极,Cu为负极 | |
| B. | 图2中Cu电极上发生的离子方程式为:Cu-2e-═Cu2+ | |
| C. | 金属铬的活泼性比铜强且能和硫酸反应生成H2 | |
| D. | 金属铬易被稀硝酸钝化 |
7.下列选项中,符合如图所示关系的是( )


| A. | 一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系 | |
| B. | 将SO2通入NaOH溶液中至过量,生成Na2SO3的物质的量(Y)与消耗SO2的物质的量(X)的关系 | |
| C. | 向AlCl3溶液中滴加稀氨水至过量,生成Al(OH)3的物质的量(Y)与消耗NH3•H2O的物质的量(X)的关系 | |
| D. | H2SO4溶液的物质的量浓度(Y)与溶液体积(X)的关系 |