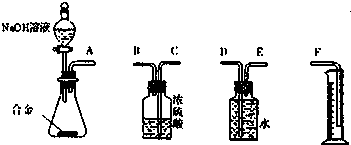
题目内容
7. (普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
(普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系) | 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | D.不十分剧烈,产生无色气体 |
| ⑤向AlCl3溶液中滴加NaOH溶液至过量 | E.生成白色胶装沉淀,继而沉淀消失 |
(1)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、AlCl3溶液、NaOH溶液、酚酞溶液等,实验所用到的玻璃仪器:①胶头滴管、试管、烧杯、酒精灯以及玻璃片等.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ | ⑤ |
| 实验现象(填A-E) | B |
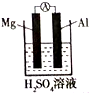
(4)该同学利用原电池原理也得出镁铝金属性的比较,他设计的原电池装置如图所示,其中正极发生的电极反应为:2H++2e-=H2↑.
分析 (1)实验中需要向溶液中滴加液体,还需要胶头滴管;
(2)①镁与热水反应生成氢气,有气泡产生,反应生成氢氧化镁,溶液呈碱性,再向溶液中滴加酚酞溶液,溶液呈红色;
②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中,化学方程式为:2Na+2H2O=2NaOH+H2↑,溶液呈碱性,有氢气生成,钠的密度小于水,熔点较低;
③④镁、铝均能与盐酸发生置换反应生成氢气,镁较铝活泼,镁条与稀盐酸反应更剧烈;
⑤向A1Cl3溶液中滴加NaOH溶液至过量,先生成Al(OH)3沉淀,进而与NaOH反应生成溶于水的NaAlO2;
(3)元素的金属性越强,对应的金属单质越活泼,越易与水或酸反应,反应越剧烈;
(4)镁、铝均与硫酸反应生成硫酸盐与氢气,Mg更活泼,Mg作负极,Al作正极,正极上是氢离子放电生成氢气.
解答 解:(1)实验中需要向溶液中滴加液体,还需要胶头滴管,
故答案为:胶头滴管;
(2)①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,镁与热水反应生成氢气,有气泡产生,反应生成氢氧化镁,溶液呈碱性,再向溶液中滴加酚酞溶液,溶液呈红色;
②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中,所以的化学方程式为:2Na+2H2O=2NaOH+H2↑,现象为:Na浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色
③镁较铝活泼,但都能与盐酸发生置换反应,将镁条投入稀盐酸中,剧烈反应,迅速产生大量无色气体,④将铝条投入稀盐酸中,反应不十分剧烈,产生无色气体;
⑤向A1Cl3溶液中滴加NaOH溶液至过量,先生成Al(OH)3沉淀,进而与NaOH反应生成溶于水的NaAlO2,先发生Al3++3OH-=Al(OH)3↓,后发生Al(OH)3+OH-=AlO2-+2H2O,现象为:生成白色胶装沉淀,继而沉淀消失,
故答案为:
| 实验内容 | ① | ② | ③ | ④ | ⑤ |
| 实验现象(填A-E) | B | A | C | D | E |
故答案为:Na>Mg>Al;
(4)镁、铝均与硫酸反应生成硫酸盐与氢气,Mg更活泼,Mg作负极,Al作正极,正极上是氢离子放电生成氢气,电极反应式为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑.
点评 本题考查物质性质探究实验,利用对比的方法进行实验,根据实验现象确定金属的金属性强弱、非金属的非金属性强弱,从而得出同一周期元素性质的递变规律,题目难度中等.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
| A. | 反应达平衡时,正反应速率和逆反应速率相等 | |
| B. | 该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| C. | 该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| D. | 同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等 |
| A. | CO3O4 | B. | WO3 | C. | MnO2 | D. | Cr2O3 |
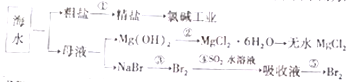 海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )
海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )| A. | 大量的氮、磷废水排入海洋,易引起赤潮 | |
| B. | 空气吹出法是用于工业规模海水提溴的常用方法 | |
| C. | 在过程③中溴元素被氧化,而在过程④中溴元素被还原 | |
| D. | 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+、等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| A. | 有机化学实验中需要用温度计的有石油分馏、硝基苯的制备和乙烯的制取 | |
| B. | 用溴水可以鉴别苯酚溶液、甲苯、乙醇和苯乙烯 | |
| C. | 用酒精可以处理粘在皮肤上的苯酚或苯酚醛树脂制备实验后的试管 | |
| D. | 取适量卤代烃水解后产物,直接滴加AgNO3溶液以确定卤原子种类 |
| A. | 一定条件下,将1molN2和3molH2混合,充分反应后转移的电子数为NA | |
| B. | 1.5molNO2与足量水反应,转移的电子数为1.5NA | |
| C. | 6.4g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| D. | 常温常压下,11.2LCl2含氯原子数为NA |

 ;
;