题目内容
18.将1.92g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则(1)反应中消耗HNO3的物质的量为0.11mol.
(2)计算所收集气体中的各成分的物质的量.
分析 (1)n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,根据N元素守恒计算消耗HNO3的物质的量;
(2)气体的物质的量=n(NO)+n(NO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,再根据得失电子守恒列出一个等式,然后联列求解.
解答 解:(1)n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,根据原子守恒得生成硝酸铜需要的n(HNO3)=2n[Cu(NO3)2]=2n(Cu)=2×0.03mol=0.06mol,气体为氮氧化物,气体的物质的量=n(NO)+n(NO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
根据N元素守恒可知共消耗硝酸的物质的量为:0.06mol+0.05mol=0.11mol,故答案为:0.11mol;
(2)气体的物质的量=n(NO)+n(NO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,再根据得失电子守恒可知:3n(NO)+n(NO2)=$\frac{1.92g}{64g/mol}$×2,解之得:n(NO)=0.005mol,n(NO2)=0.045mol,
答:一氧化氮和二氧化氮的物质的量分别为:0.005mol和0.045mol.
点评 本题考查了物质的量的有关计算,根据氮原子守恒和电子得失守恒来分析解答即可,难度中等.

练习册系列答案
相关题目
9.下列分子中的中心原子的杂化类型为sp2杂化的是( )
| A. | BeCl2 | B. | NH3 | C. | BF3 | D. | H2O |
6.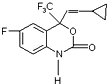 M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
 M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )| A. | 该物质易溶于水 | |
| B. | M能发生缩聚反应 | |
| C. | M分子内至少有15个原子在同一个平面上 | |
| D. | M的分子式为C13H22O2NF4 |
13.下列各组物质的性质比较,正确的是( )
| A. | 还原性:F-<Cl-<Br-<I- | B. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | ||
| C. | 氢化物稳定性:H2S>HF>H2O | D. | 酸性:HClO4>H3PO4>H2SO4 |
3.关于化学反应中的能量变化,下列说法中不正确的是( )
| A. | 化学反应中的能量变化,主要是由化学键的变化引起的 | |
| B. | 对于可逆反应:aA(g)+bB(g)═bC(g)+dD(g),如果正反应是放热反应,逆反应一定是吸热反应 | |
| C. | 氢气燃烧生成水是一个放热反应,说明1mol H2的能量高于1mol H2O的能量 | |
| D. | 加热才能发生的反应,不一定是吸热反应 |
10.设NA为阿伏加德罗常数,下列叙述不正确的是( )
| A. | 标准状况下,1 L庚烷完全燃烧所生成的气态分子数不是$\frac{7}{22.4}$NA | |
| B. | 28 g丙烯中含有的共用电子对数为6NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为NA | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为9NA |
7.下列推断正确的是( )
| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: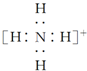 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CH4分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键D |
8.L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图所示,这种药物的研制是基于获得2000年诺贝尔生理学和医学奖、2001年诺贝尔化学奖的研究成果.下列关于 L-多巴酸性质的叙述正确的是( )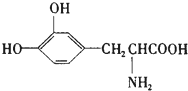

| A. | 只能与碱反应,不能与酸反应 | B. | 1mol该物质最多可与4molNaOH反应 | ||
| C. | 该物质不能使酸性KMnO4褪色 | D. | 1mol该物质最多可与1molHBr反应 |
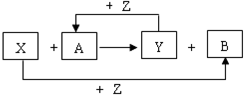 X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):
X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应): ;
; 或
或 ;
;