题目内容
7.下列推断正确的是( )| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: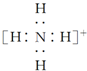 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CH4分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键D |
分析 根据价层电子对互斥理论确定分子的空间构型和杂化方式,价层电子对个数=σ键个数+孤电子对个数.
解答 解:A.三氟化硼中硼原子含有3个σ键且不含孤电子对,所以三氟化硼是平面三角形结构,故A错误;
B.氨根离子中氮原子含有4个σ键且不含孤电子对,所以铵根离子是正四面体结构,故B错误;
C.甲烷分子中碳原子含有4个σ键且不含孤电子对,所以碳原子以sp3杂化,分子中的碳原子以2个2s电子和2个2p电子分别与4个氢原子的1s轨道重叠,形成4个C-Hσ键,故C错误;
D.甲烷分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-Hσ键,且四个C-H完全相同,故D正确;
故选D.
点评 本题考查了分子的空间构型的判断、杂化方式的判断等知识点,注意甲烷分子中4个C-H化学键如何形成的,为易错点.

练习册系列答案
相关题目
17.下列有关元素周期表中的某些推断正确的是( )
| A. | 位于同一主族的元素的价电子数相同,则各元素的常见化合价也一定相同 | |
| B. | 碱金属族元素同卤族元素一样,其单质的熔沸点随元素原子序数的增大而逐渐升高 | |
| C. | 若x是ⅡB族中元素的原子序数,那么原子序数为x+1的元素是ⅢA族 | |
| D. | 在周期表中金属和非金属元素的分界线附近的元素是过渡元素 |
15.某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
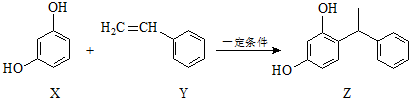
下列叙述错误的是( )

下列叙述错误的是( )
| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| C. | 上述反应X+Y→Z属于加成反应 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
12.下列表达式正确的是( )
| A. | 碳原子的L层电子轨道表示式: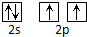 | |
| B. | 氯化氢的电子式: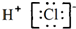 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:${\;}_{6}^{12}$C |
19.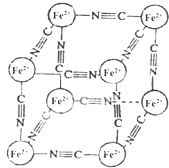 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )| A. | 该晶体中既有离子键又有极性共价键 | |
| B. | 晶体的化学式可表示为[M2Fe(CN)3] | |
| C. | M+离子位于晶胞体心 | |
| D. | 与每个Fe2+距离相等且最近的CN-有6个 |
16.氮元素的化合物种类繁多,性质也各不相同
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
①反应开始直至10min时,N2O4的平均反应速率为:0.0025mol/L•min
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| n(NO2)/mol | 0.400 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.
17.有八种物质:①甲烷 ②苯 ③聚乙烯 ④聚乙炔 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯 ⑧环己烯,既能使酸性KMnO4溶液褪色,又能与溴水反应使之褪色的是( )
| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
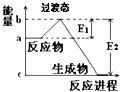 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.