题目内容
9.下列分子中的中心原子的杂化类型为sp2杂化的是( )| A. | BeCl2 | B. | NH3 | C. | BF3 | D. | H2O |
分析 根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂质类型.
解答 解:A.BeCl2中Be形成2个δ键,无孤电子对,为sp杂化,故A错误;
B.NH3中N形成3个δ键,孤电子对数=$\frac{5-3×1}{2}$=1,为sp3杂化,故B错误;
C.BF3中B形成3个δ键,无孤电子对,为sp2杂化,故C正确;
D.H2O中O形成2个δ键,孤电子对数=$\frac{6-2×1}{2}$=2,为sp3杂化,故D错误;
故选:C.
点评 本题考查了原子杂化类型的判断,难度不大,根据杂化轨道数=δ键数+孤对电子对数来解答即可,原子杂化类型的判断是高考的热点.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
20.下列有关实验的叙述,正确的是( )
| A. | 分馏石油时,温度计的水银球必须插入液面下 | |
| B. | 用浓氨水洗涤做过银镜反应的试管 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加直至沉淀刚好溶解为止 | |
| D. | 蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖 |
17.下列有关元素周期表中的某些推断正确的是( )
| A. | 位于同一主族的元素的价电子数相同,则各元素的常见化合价也一定相同 | |
| B. | 碱金属族元素同卤族元素一样,其单质的熔沸点随元素原子序数的增大而逐渐升高 | |
| C. | 若x是ⅡB族中元素的原子序数,那么原子序数为x+1的元素是ⅢA族 | |
| D. | 在周期表中金属和非金属元素的分界线附近的元素是过渡元素 |
4.下列物质的电子式书写正确的是( )
| A. | 氯化氢  | B. | 二氧化碳  | ||
| C. | 氮气  | D. | 氯化镁  |
14.化学键是( )
| A. | 只存在于分子之间 | |
| B. | 是相邻的两个或多个原子或离子之间强烈的相互作用 | |
| C. | 只存在于离子之间 | |
| D. | 是相邻的两个或多个离子之间强烈的静电作用 |
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 增大压强能缩短碘化氢分解反应达到平衡的时间 | |
| B. | 配制硫酸铁溶液时,向溶液中加入少量硫酸 | |
| C. | 往醋酸溶液中加碱溶液,使c(CH3COO-) 增大 | |
| D. | 向水中加入酸可抑制水的电离 |
19.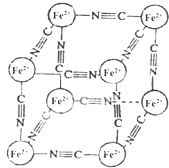 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )| A. | 该晶体中既有离子键又有极性共价键 | |
| B. | 晶体的化学式可表示为[M2Fe(CN)3] | |
| C. | M+离子位于晶胞体心 | |
| D. | 与每个Fe2+距离相等且最近的CN-有6个 |