题目内容
13.下列各组物质的性质比较,正确的是( )| A. | 还原性:F-<Cl-<Br-<I- | B. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | ||
| C. | 氢化物稳定性:H2S>HF>H2O | D. | 酸性:HClO4>H3PO4>H2SO4 |
分析 A、元素的非金属性越强,对应离子的还原性越弱;
B、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
C、根据元素周期律的递变规律判断对应元素非金属性的强弱,元素的非金属性越强,对应的氢化物越稳定;
D、首先判断元素的非金属性强弱,非金属性越强,则对应的最高价氧化物的水化物的酸性越强.
解答 解:A、元素的非金属性F>Cl>Br>I,元素的非金属性越强,则对应的阴离子的还原性越弱,离子的还原性:F-<Cl-<Br-<I-,故A正确;
B、金属性:Al<Mg<Na,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则碱性:Al(OH)3<Mg(OH)2<NaOH,故B错误;
C、非金属性:F>O>S,元素的非金属性越强,对应的氢化物越稳定,则稳定性:HF>H2O>H2S,故C错误;
D、根据元素周期律可知元素的非金属性:Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,故D错误,
故选A.
点评 本题考查元素周期表与元素周期律的综合应用,题目难度不大,本题注意把握元素周期律的递变规律,注重基础积累的积累即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列物质的电子式书写正确的是( )
| A. | 氯化氢  | B. | 二氧化碳  | ||
| C. | 氮气  | D. | 氯化镁  |
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 增大压强能缩短碘化氢分解反应达到平衡的时间 | |
| B. | 配制硫酸铁溶液时,向溶液中加入少量硫酸 | |
| C. | 往醋酸溶液中加碱溶液,使c(CH3COO-) 增大 | |
| D. | 向水中加入酸可抑制水的电离 |
8.某有机物具有下列性质:能发生银镜反应;滴入石蕊试液不变色;加入少量碱液并滴入酚酞试液,共煮时红色逐渐消失.该有机物可能是( )
| A. | 甲酸乙酯 | B. | 甲酸 | C. | 乙酸 | D. | 乙酸甲酯 |
5.下列物质中互为同分异构体的是( )
| A. | 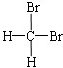 与 与 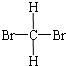 | B. | 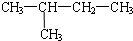 与 与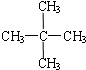 | C. | CH4和CH3CH3 | D. | 淀粉和纤维素 |
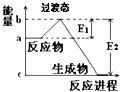 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.