题目内容
3.关于化学反应中的能量变化,下列说法中不正确的是( )| A. | 化学反应中的能量变化,主要是由化学键的变化引起的 | |
| B. | 对于可逆反应:aA(g)+bB(g)═bC(g)+dD(g),如果正反应是放热反应,逆反应一定是吸热反应 | |
| C. | 氢气燃烧生成水是一个放热反应,说明1mol H2的能量高于1mol H2O的能量 | |
| D. | 加热才能发生的反应,不一定是吸热反应 |
分析 A.化学反应的实质是旧键的断裂和新键的生成;
B.正反应放热,说明反应物的总能量高于生成物的总能量,而逆反应则是将总能量低的生成物转化为总能量高的反应物;
C.反应热是反应物和生成物的能量差值;
D.反应条件与反应的吸热、放热无关.
解答 解:A.化学反应的实质是旧键的断裂和新键的生成,化学反应中的能量变化主要由化学键的断裂和生成引起的,故A正确;
B.因为正反应放热,说明反应物的总能量高于生成物的总能量,而逆反应则是将总能量低的生成物转化为总能量高的反应物,则逆反应一定是吸热,故B正确;
C.氢气燃烧放热,说明氢气和氧气的能量和比水高,不变说明氢气比氧气能量高,故C错误;
D.反应条件与反应的吸热、放热无关,则需加热才能发生的反应可能为吸热反应,也可能为放热反应,即不一定是吸热反应,故D正确.
故选C.
点评 本题考查学生化学能和热能之间的关系以及常见的放热反应和吸热反应知识,注意知识的梳理和归纳是解题的关键,难度不大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
14.化学键是( )
| A. | 只存在于分子之间 | |
| B. | 是相邻的两个或多个原子或离子之间强烈的相互作用 | |
| C. | 只存在于离子之间 | |
| D. | 是相邻的两个或多个离子之间强烈的静电作用 |
8.分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,在一定条件下B能转化成C.下列说法正确的是( )
| A. | 有机物B的红外线谱图出现C=O键的振动吸收 | |
| B. | 有机物C的核磁共振氢谱有可能是三个吸收峰 | |
| C. | 有机物A的结构可能有4种 | |
| D. | 有机物C可以发生缩聚反应 |
15.某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
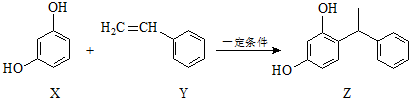
下列叙述错误的是( )

下列叙述错误的是( )
| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| C. | 上述反应X+Y→Z属于加成反应 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
12.下列表达式正确的是( )
| A. | 碳原子的L层电子轨道表示式: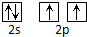 | |
| B. | 氯化氢的电子式: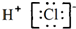 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:${\;}_{6}^{12}$C |
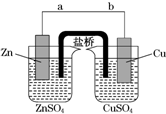 某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题: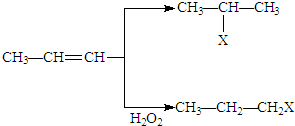 (X为卤素原子)
(X为卤素原子)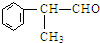 的物质,该物质是一种香料.
的物质,该物质是一种香料.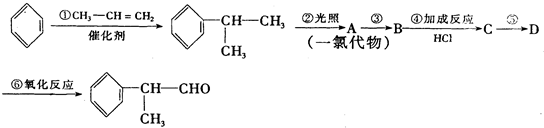
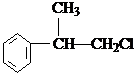 、
、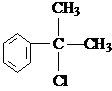 .
.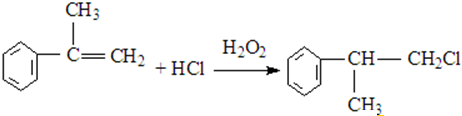 .
. 、
、 、
、 任意2种.
任意2种.