题目内容
20. 铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3+6OH--6e-=N2+6H2O反应的电极为阳极(填“阴”、“阳”)极;
②•OH(羟自由基)电氧化
在电流作用下,利用产生的强氧化性中间产物•OH脱氮;•OH中O元素的化合价-1;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮.请写出HClO在酸性条件下氧化NH4+的离子方程式3HClO+2NH4+=N2↑+3Cl-+5H++3H2O.
(2)探究适宜的实验条件
如图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择10A.
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有•OH;
假设二:只有HClO;
假设三:既有•OH又有HClO.
(4)请你设计实验探究脱氮过程中是否有•OH产生,完成下表内容.
| 实验方案 | 预期实验结果和结论 |
| 配制一定pH、NH4+和Cl-浓度的溶液,用最佳电流强度,电解样品90min后,采用电子自旋共振法检测样品中•OH |
分析 (1)①根据原电池工作原理分析,阳极发生氧化反应、阴极发生还原反应;
②根据氢元素的化合价为+1判断氧元素的化合价;
③在碱性条件下,发生2NH3+6OH--6e-=N2+6H2O反应的电极为阳极,电解池的阳极发生氧化反应.在电流作用下,利用产生的强氧化性中间产物•OH脱氮;•OH中O元素的化合价为-1.HClO在酸性条件下氧化NH4+的离子方程式为3HClO+2NH4+=N2↑+3Cl-+5H++3H2O;
(2)综合考虑能耗因素,电流强度应选择10A时,脱氮的效果最好.
(3)根据假设一和假设二判断假设三;
(4)检测到•OH,则假设成立,否则假设不成立;
(5)根据氢离子对可逆反应Cl2+H2O?H++Cl-+HClO的影响分析.
解答 解:(1)①在碱性条件下,发生2NH3+6OH--6e-=N2+6H2O反应的电极为阳极,电解池的阳极发生氧化反应,
故答案为:阳极;
②在电流作用下,利用产生的强氧化性中间产物•OH脱氮,•OH中H元素为+1,则O元素的化合价为-1,
故答案为:-1;
③HClO在酸性条件下将铵根离子氧化成氮气,据此写出反应的离子方程式;
(2)根据图示曲线变化,并结合能耗因素分析最佳电流;
(3)根据假设一和假设二可知假设三为:既有•OH又有HClO,
故答案为:既有•OH又有HClO;
| 预期实验结果和结论 |
| 若检测到一定浓度的•OH,则假设成立,反之,假设不成立. |
故答案为:
| 实验方案 | 预期实验结果和结论 |
| 若检测到一定浓度的•OH,则假设成立,反之,假设不成立 |
(5)酸性较强时,Cl2+H2O?H++Cl-+HClO的化学平衡逆向移动,生成的HClO减少,不利脱氮,故弱酸性溶液中比强酸溶液中更利于使NH4+转化为N2而脱氮,
故答案为:酸性较强时,Cl2+H2O?H++Cl-+HClO的化学平衡逆向移动,生成的HClO减少,不利脱氮.
点评 本题考查了探究反应原理,题目难度中等,试题涉及电解原理及其应用、影响化学平衡的因素、离子方程式书写等等知识,试题知识点较多、充分考查学生的分析、理解能力及归纳总结能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.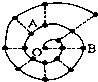 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中可能含有共价键 |
8.短周期主族元素X、Y、Z、W在元素周期表中的位置关系如下图,下列推论合理的是( )
| X | Y |
| W | Z |
| A. | 若X、Y、Z、W中只有一种为金属元素,则W一定为铝元素 | |
| B. | 若W的核电荷数是Y的两倍,则W的氧化物可作半导体材料 | |
| C. | 若Z的核电荷数是Y的两倍,则X的氢化物水溶液显酸性 | |
| D. | 若Y、W的简单阴离子都能破坏水的电离,则Z的简单阴离子也一定能破坏水的电离 |
15.国内科研机构对城市雾霾天气进行了研究,一种新的污染物过氧乙酰硝酸酯(PAN)被检出引起了人们的注意,研究表明对眼睛具有强烈刺激作用的过氧乙酰硝酸酯产生原理可用以下方程式表示为C2H6+NO2+O2→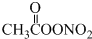 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )
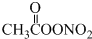 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )| A. | C2H6分子中只存在极性键 | |
| B. | PAN中氧元素化合价均为-2 | |
| C. | 每消耗11.2L O2转移电子的物质的量为2 mol | |
| D. | PAN可水解成硝酸和有机酸,是导致酸雨的原因之一 |
5.取底部沉积有NaCl固体的NaCl饱和溶液,滴加1-2滴浓盐酸(约12mol/L),即可观察到大量白色沉淀产生.根据上述事实及所学知识,下列说法正确的是( )
①析出的沉淀是NaCl
②推测饱和氯化钠溶液的浓度小于12mol/L
③得到的混合溶液中存在着溶解平衡
④加入浓盐酸后,NaCl的溶解速率小于NaCl的沉淀速率
⑤加热浓缩或降温也可以使NaCl析出.
①析出的沉淀是NaCl
②推测饱和氯化钠溶液的浓度小于12mol/L
③得到的混合溶液中存在着溶解平衡
④加入浓盐酸后,NaCl的溶解速率小于NaCl的沉淀速率
⑤加热浓缩或降温也可以使NaCl析出.
| A. | 全部 | B. | ①③④ | C. | ①③④⑤ | D. | ②③④⑤ |
9.下列关于氨水的说法中,不正确的是( )
| A. | 氨水和液氨不同,氨水是混合物,液氨是纯净物 | |
| B. | 氨水中物质的量浓度最大的粒子是NH3•H2O(除水) | |
| C. | 氨水显弱碱性,故通常保存在金属容器中 | |
| D. | 在1 mol•L-1氨水中,NH3•H2O、NH${\;}_{4}^{+}$、NH3的物质的量浓度之和为1 mol•L-1 |
11.下列做法中符合“绿色化学”思想的是( )
| A. | CO2不是大气污染物,所以可以大量排放到空气中 | |
| B. | 以无磷洗涤剂代替含磷洗涤剂 | |
| C. | 实验后的有毒有害物质应分类收集,统一处理 | |
| D. | 在通风橱中制取氯气时不用NaOH溶液吸收尾气 |