题目内容
8.短周期主族元素X、Y、Z、W在元素周期表中的位置关系如下图,下列推论合理的是( )| X | Y |
| W | Z |
| A. | 若X、Y、Z、W中只有一种为金属元素,则W一定为铝元素 | |
| B. | 若W的核电荷数是Y的两倍,则W的氧化物可作半导体材料 | |
| C. | 若Z的核电荷数是Y的两倍,则X的氢化物水溶液显酸性 | |
| D. | 若Y、W的简单阴离子都能破坏水的电离,则Z的简单阴离子也一定能破坏水的电离 |
分析 A.若X、Y、Z、W中只有一种为金属元素,由元素在短周期中位置可知,W只能为Al;
B.若W的核电荷数是Y的两倍,设Y的核电荷数为a,则W的核电荷数为(a-1+8),故a+7=2a,解得a=7,故W为Si;
C.若Z的核电荷数是Y的两倍,则Y为O、Z为S、X为N、W为P;
D.若Y、W的简单阴离子都能破坏水的电离,可以是Y为F、Z为S、Z为S、X为O.
解答 解:A.若X、Y、Z、W中只有一种为金属元素,由元素在短周期中位置可知,W只能为Al,故A正确;
B.若W的核电荷数是Y的两倍,设Y的核电荷数为a,则W的核电荷数为(a-1+8),故a+7=2a,解得a=7,故W为Si,硅晶体可用作半导体材料,其氧化物为二氧化硅,可作光导纤维,故B错误;
C.若Z的核电荷数是Y的两倍,则Y为O、Z为S、X为N、W为P,X的氢化物水溶液显碱性,故C错误;
D.若Y、W的简单阴离子都能破坏水的电离,可以是Y为F、Z为S、Z为S、X为O,氯离子不能破坏水的电离,故D错误,
故选A.
点评 本题考查元素周期表结构,需要学生熟练掌握短周期元素与元素化合物性质,注意元素的不确定性,难度不大.

练习册系列答案
相关题目
18.已知:3NO3-+8Al+5OH-+2H2O$\stackrel{△}{→}$3NH3↑+8AlO2-.某地区的雾霾中可能含有如下可溶性离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、HCO3-、Cl-.某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成如下实验:
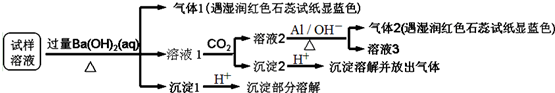
根据以上的实验操作与现象,该同学得出的结论错误的是( )

根据以上的实验操作与现象,该同学得出的结论错误的是( )
| A. | 试样中肯定存在NH4+、SO42-和NO3-,可能有Mg2+ | |
| B. | 试样中不一定存在Na+、Cl-、HCO3- | |
| C. | 沉淀2中可能含碳酸钡、碳酸镁和氢氧化铝 | |
| D. | 该雾霾中可能存在NaNO3、NH4HCO3和MgSO4 |
19.下列说法正确的是( )
| A. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” | |
| B. | 硅晶体的导电性介于导体与绝缘体之间,是一种重要的半导体材料,广泛应用于制造集成电路、光导纤维、太阳能电池板等 | |
| C. | pH计不能用于酸碱中和滴定终点的判断 | |
| D. | 2013年11月22日,中科院国家纳米科学中心宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据.水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 |
16.常温下,下列各组离子在制定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液:Mg2+、Fe2+、SO42-、NO3- | |
| B. | 弱碱性溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 使石蕊显紫色的溶液:Al3+、K+、SO42-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42- |
3.已知常温下,浓度均为0.1mol•L-1的5种钠盐溶液pH如表:
下列说法中正确的是( )
| 溶质 | Na2CO3 | NaClO | NaHCO3 | CH3COONa | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 8.8 | 5.2 |
| A. | 少量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=2H++Cl-+SO42- | |
| B. | 常温下,稀释CH3COOH或HClO溶液时,溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$不变(HR代表CH3COOH或HClO) | |
| C. | 等体积、等物质的量浓度的Na2CO3、CH3COONa、NaHSO3三种溶液混合,溶液中:c(HSO3-)>c(CH3COO-)>c(CO32-) | |
| D. | 含等物质的量的NaHCO3和CH3COONa的混合液中:c(OH-)-c(H+)=c(H2CO3)+c(CH3COOH) |
13.已知温度T时KW=1.0×10-12,0.1mol/L Na2A溶液pH=6,则下列说法中,正确的是( )
| A. | 该温度下,0.005mol/L H2A溶液中水电离出的c(H+)=10-12mol/L | |
| B. | H2A在水溶液中的电离方程式为:H2A?H++HA-,HA-?A2-+H+ | |
| C. | (NH4)2A溶液中存在离子浓度关系:(NH4+)>(A2-)>(H+)>(OH-) | |
| D. | 等体积等浓度的盐酸与H2A溶液分别与5.6gFe反应,H2A产生的H2多 |
20. 铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3+6OH--6e-=N2+6H2O反应的电极为阳极(填“阴”、“阳”)极;
②•OH(羟自由基)电氧化
在电流作用下,利用产生的强氧化性中间产物•OH脱氮;•OH中O元素的化合价-1;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮.请写出HClO在酸性条件下氧化NH4+的离子方程式3HClO+2NH4+=N2↑+3Cl-+5H++3H2O.
(2)探究适宜的实验条件
如图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择10A.
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有•OH;
假设二:只有HClO;
假设三:既有•OH又有HClO.
(4)请你设计实验探究脱氮过程中是否有•OH产生,完成下表内容.
(5)研究得知,脱氮过程主要以原理③为主,弱酸性溶液中比强酸溶液中更利于使NH4+转化为N2而脱氮,请从化学平衡移动的角度解释其原因酸性较强时,Cl2+H2O?H++Cl-+HClO的化学平衡逆向移动,生成的HClO减少,不利脱氮.
 铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3+6OH--6e-=N2+6H2O反应的电极为阳极(填“阴”、“阳”)极;
②•OH(羟自由基)电氧化
在电流作用下,利用产生的强氧化性中间产物•OH脱氮;•OH中O元素的化合价-1;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮.请写出HClO在酸性条件下氧化NH4+的离子方程式3HClO+2NH4+=N2↑+3Cl-+5H++3H2O.
(2)探究适宜的实验条件
如图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择10A.
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有•OH;
假设二:只有HClO;
假设三:既有•OH又有HClO.
(4)请你设计实验探究脱氮过程中是否有•OH产生,完成下表内容.
| 实验方案 | 预期实验结果和结论 |
| 配制一定pH、NH4+和Cl-浓度的溶液,用最佳电流强度,电解样品90min后,采用电子自旋共振法检测样品中•OH |
17.用下列装置进行相应实验,能达到实验目的是( )
| 选项 | A | B | C | D |
| 装置 | 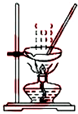 | 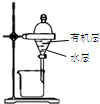 有机层水层 | 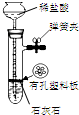 | 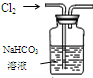 |
| 目的 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 分离CCl4萃取碘水后已分层的有机层和水层 | 制取少量CO2气体 | 除去Cl2中含有的少量HCl |
| A. | A | B. | B | C. | C | D. | D |