题目内容
15.国内科研机构对城市雾霾天气进行了研究,一种新的污染物过氧乙酰硝酸酯(PAN)被检出引起了人们的注意,研究表明对眼睛具有强烈刺激作用的过氧乙酰硝酸酯产生原理可用以下方程式表示为C2H6+NO2+O2→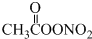 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )| A. | C2H6分子中只存在极性键 | |
| B. | PAN中氧元素化合价均为-2 | |
| C. | 每消耗11.2L O2转移电子的物质的量为2 mol | |
| D. | PAN可水解成硝酸和有机酸,是导致酸雨的原因之一 |
分析 A.含C-C和C-H键;
B.过氧根中O-O为-1价;
C.状况未知,不能利用体积计算;
D.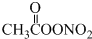 水解,生成硝酸和过氧乙酸.
水解,生成硝酸和过氧乙酸.
解答 解:A.C2H6分子中存在极性键C-H和非极性键C-C,故A错误;
B.PAN中氧元素化合价不都是-2价,过氧根中O-O为-1价,故B错误;
C.没给标况条件,Vm未知,不能利用体积计算其物质的量,故C错误;
D.PAN可水解成硝酸和有机酸,硝酸使雨水酸性增强,是导致酸雨的原因之一,故D正确;
故选D.
点评 本题以信息的形式考查有机物的结构与性质,为高频考点,把握习题中的信息、化学键判断及化学与环境的关系为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.铋酸钠(NaBiO3)溶液呈无色.向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:
请比较实验中所有的氧化剂和氧化产物的氧化性强弱关系(反应过程中的涉及的气体均不参与比较):NaBiO3>NaMnO4>H2O2>I2.
| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
6.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 17.6 g丙烷中所含的共价键数目为4NA | |
| B. | 常温下,pH=13的NaOH溶液中含有的OH-离子数目为0.1NA | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数目为0.5NA | |
| D. | 电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA |
3.已知常温下,浓度均为0.1mol•L-1的5种钠盐溶液pH如表:
下列说法中正确的是( )
| 溶质 | Na2CO3 | NaClO | NaHCO3 | CH3COONa | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 8.8 | 5.2 |
| A. | 少量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=2H++Cl-+SO42- | |
| B. | 常温下,稀释CH3COOH或HClO溶液时,溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$不变(HR代表CH3COOH或HClO) | |
| C. | 等体积、等物质的量浓度的Na2CO3、CH3COONa、NaHSO3三种溶液混合,溶液中:c(HSO3-)>c(CH3COO-)>c(CO32-) | |
| D. | 含等物质的量的NaHCO3和CH3COONa的混合液中:c(OH-)-c(H+)=c(H2CO3)+c(CH3COOH) |
10.下列应用涉及氧化还原反应的是( )
| A. | 用食醋清洗烧水壶的水垢 | |
| B. | 用铝盐、铁盐作净水剂 | |
| C. | 用硫磺粉处理散落在地上的汞 | |
| D. | 用丁达尔现象区分食盐水和淀粉溶液 |
20. 铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3+6OH--6e-=N2+6H2O反应的电极为阳极(填“阴”、“阳”)极;
②•OH(羟自由基)电氧化
在电流作用下,利用产生的强氧化性中间产物•OH脱氮;•OH中O元素的化合价-1;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮.请写出HClO在酸性条件下氧化NH4+的离子方程式3HClO+2NH4+=N2↑+3Cl-+5H++3H2O.
(2)探究适宜的实验条件
如图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择10A.
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有•OH;
假设二:只有HClO;
假设三:既有•OH又有HClO.
(4)请你设计实验探究脱氮过程中是否有•OH产生,完成下表内容.
(5)研究得知,脱氮过程主要以原理③为主,弱酸性溶液中比强酸溶液中更利于使NH4+转化为N2而脱氮,请从化学平衡移动的角度解释其原因酸性较强时,Cl2+H2O?H++Cl-+HClO的化学平衡逆向移动,生成的HClO减少,不利脱氮.
 铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3+6OH--6e-=N2+6H2O反应的电极为阳极(填“阴”、“阳”)极;
②•OH(羟自由基)电氧化
在电流作用下,利用产生的强氧化性中间产物•OH脱氮;•OH中O元素的化合价-1;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮.请写出HClO在酸性条件下氧化NH4+的离子方程式3HClO+2NH4+=N2↑+3Cl-+5H++3H2O.
(2)探究适宜的实验条件
如图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择10A.
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有•OH;
假设二:只有HClO;
假设三:既有•OH又有HClO.
(4)请你设计实验探究脱氮过程中是否有•OH产生,完成下表内容.
| 实验方案 | 预期实验结果和结论 |
| 配制一定pH、NH4+和Cl-浓度的溶液,用最佳电流强度,电解样品90min后,采用电子自旋共振法检测样品中•OH |
7.下列微粒中,未成对电子数最多的是( )
| A. | 氮原子 | B. | 氧原子 | C. | 铁离子 | D. | 铬原子 |
4.在过氧化钾与水的反应中,其还原产物和氧化产物质量比为( )
| A. | 7:2 | B. | 4:7 | C. | 7:4 | D. | 9:8 |
6.下面是同周期元素原子的价电子排布式,第一电离能最小的原子可能是( )
| A. | ns2np3 | B. | ns2np5 | C. | ns2np4 | D. | ns2np6 |