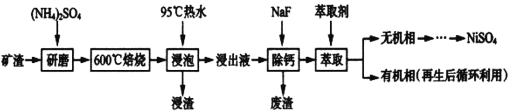
题目内容
【题目】下列解释事实的离子方程式中,不正确的是![]()
A.铝片放入NaOH溶液中有气体产生:![]()
B.泡沫灭火器灭火的原理:![]()
C.氨水吸收少量![]() 防止污染空气:
防止污染空气:![]()
D.“84”消毒液中滴少量白醋可增强漂白性:![]()
【答案】C
【解析】
A.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
B.泡沫灭火器的灭火原理:铝离子与碳酸根离子发生双水解反应;
C.氨水与少量的二氧化硫反应生成亚硫酸铵;
D.醋酸的酸性大于次氯酸,醋酸能与次氯酸盐反应生成次氯酸。
![]() 片置于NaOH溶液中,产生气体,反应的离子方程式为:
片置于NaOH溶液中,产生气体,反应的离子方程式为:![]() ,故A正确;
,故A正确;
B.泡沫灭火器的灭火原理:铝离子与碳酸氢根离子发生双水解反应,离子方程式为:![]() ,故B正确;
,故B正确;
C.氨水与少量的二氧化硫反应生成亚硫酸铵,没有亚硫酸氢根离子生成,正确的离子方程式为:![]() ,故C错误;
,故C错误;
D.醋酸的酸性大于次氯酸,醋酸能与次氯酸盐反应生成次氯酸,则“84”消毒液中滴少量白醋可增强漂白性:![]() ,故D正确;
,故D正确;
故选:C。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】回收和利用CO2是环境科学家研究的热点,是减轻温室效应危害的重要途径。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为_____________。
(2)CO2经过催化氢化合成低碳烯烃。合成乙烯的反应为
2CO2(g)+6H2(g)==CH2=CH2(g)+4H2O(g) △H=akJ/mol
已知:
键 | H-H | C=O | C=C | O-H | C-H |
键能/kJ/mol | 436.0 | 745.0 | 615.0 | 462.8 | 413.4 |
则a=________。
(3)T℃时。在恒容密闭容器中充入1molCO2和nmolH2,在一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。
CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。


(4) 工业上也用合成气(H2和CO) 合成甲醇,反应为2H2(g)+CO(g)![]() CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是_________。
②已知300℃时上述反应达到平衡时,CO 的平衡转化率为60% 若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH 若保持温度和容器休积不变,则平衡会_____(填“正向移动”“逆向移动”或“不移动”)。
(5)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下图所示:

①阳极区产生CO2的原因是________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因____________。