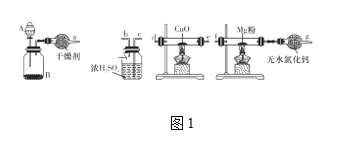
题目内容
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如下图是从该矿渣中回收NiSO4的工艺路线:
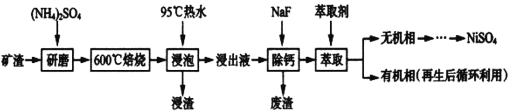
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第IVA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是_______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为_________________________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有___________________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将:Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍:除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为_________________________________________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___mol· L-1。[已知KSP(CaF2)=4.0×10-11]
(5)已知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。已知电解总反应为:2C6H13COONa+2CH3OH![]() C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
【答案】增大接触面积,加快反应速率,使反应更充分 Fe3++2H2O![]() FeO(OH)↓+3H+ SiO2、CaSO4 0.5 Cr2O72- +6Fe2++14H+ =2Cr3++6Fe3++7H2O c (F- ) =2.0×10-3 mol·L-1 2C6H13COO--2e- =C12H26+2CO2↑
FeO(OH)↓+3H+ SiO2、CaSO4 0.5 Cr2O72- +6Fe2++14H+ =2Cr3++6Fe3++7H2O c (F- ) =2.0×10-3 mol·L-1 2C6H13COO--2e- =C12H26+2CO2↑
【解析】
(1)研磨可增大接触面积,使反应速率加快;
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)为水解反应,矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵加热浸取后的浸渣为不反应和不溶于水的硫酸钙和二氧化硅;
(3)用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,根据氧化还原反应的定量关系计算得到SnC12的物质的量不少于Fe3+物质的量的倍数,用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,由此分析离子方程式的书写;
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,剩余的Ca2+为1%×1.0×10-3mol·L-1=1.0×10-5mol·L-1,结合Ksp得计算公式计算出c(F-);
(5)由电解的总反应可知,C6H13COONa 生成C12H26,C元素化合价升高,被氧化,为阳极反应。
(1)研磨可增大接触面积,使反应速率加快,使反应更充分;
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)为水解反应,反应的离子方程式为:Fe3++2H2O![]() FeO(OH)↓+3H+,加入硫酸铵加热浸取后的浸渣为不反应和不溶于水的CaS04和SiO2;
FeO(OH)↓+3H+,加入硫酸铵加热浸取后的浸渣为不反应和不溶于水的CaS04和SiO2;
(3)用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,反应为2Fe3++Sn2+= Sn4++2Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的一半,为0.5倍;用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,反应的离子方程式为:Cr2O72- +6Fe2++14H+ =2Cr3++6Fe3++7H2O;
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,剩余的Ca2+为1%×1.0×10-3mol·L-1=1.0×10-5mol·L-1,那么c(F-)=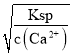 =
=![]() =2.0×10-3mol/L;
=2.0×10-3mol/L;
(5)C6H13COONa 生成C12H26,C元素化合价升高,被氧化,为阳极反应,电极反应为:2C6H13COO--2e- =C12H26+2CO2↑。

【题目】S2Cl2和SCl2均为重要的化工原料,都满足8电子稳定结构。
已知:①S2(1)+Cl2(g)![]() S2Cl2(g) △H1=xkJ/mol
S2Cl2(g) △H1=xkJ/mol
②S2Cl2(g)+Cl2(g)![]() 2SCl2(g) △H2=ykJ/mol
2SCl2(g) △H2=ykJ/mol
③相关化学键的键能如下表所示:
化学键 | S-S | S-Cl | Cl-Cl |
键能/kJ/mol | a | b | c |
下列说法错误的是
A. SCl2的结构式为C1-S-Cl B. S2Cl2的电子式为: ![]()
C. y=2b-a-c D. 在S2(1)+2Cl2(g)![]() 2SCl2(g)的反应中,△H=(x+y)kJ/mol
2SCl2(g)的反应中,△H=(x+y)kJ/mol