题目内容
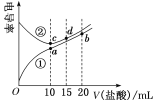
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是( )
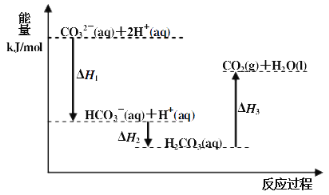
A.反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应
B.CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) H=(H1+H2+H3)
C.H1>H2 H2<H3
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则H3变小
【答案】B
【解析】
由图象可知,CO32-(aq)+2H+(aq)生成HCO3-(aq)+H+(aq)以及HCO3-(aq)+H+(aq)生成H2CO3(aq)都为放热反应,H2CO3(aq)生成CO2(g)+H2O(l)为吸热反应,结合图象中能量的高低分析解答。
A.由图象可知,反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)为吸热反应,故A错误;
B.由盖斯定律可知CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3),故B正确;
C.由图象可知,能量差值越大,反应热的绝对值越大,△H1、△H2都为放热反应,则△H1<△H2,故C错误;
D.加入催化剂,反应热不变,故D错误;
故选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目