题目内容
【题目】回收和利用CO2是环境科学家研究的热点,是减轻温室效应危害的重要途径。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为_____________。
(2)CO2经过催化氢化合成低碳烯烃。合成乙烯的反应为
2CO2(g)+6H2(g)==CH2=CH2(g)+4H2O(g) △H=akJ/mol
已知:
键 | H-H | C=O | C=C | O-H | C-H |
键能/kJ/mol | 436.0 | 745.0 | 615.0 | 462.8 | 413.4 |
则a=________。
(3)T℃时。在恒容密闭容器中充入1molCO2和nmolH2,在一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。
CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。


(4) 工业上也用合成气(H2和CO) 合成甲醇,反应为2H2(g)+CO(g)![]() CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是_________。
②已知300℃时上述反应达到平衡时,CO 的平衡转化率为60% 若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH 若保持温度和容器休积不变,则平衡会_____(填“正向移动”“逆向移动”或“不移动”)。
(5)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下图所示:

①阳极区产生CO2的原因是________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因____________。
【答案】 CO2![]() C+O2 -375 C 在恒容密闭容器中,随着氢气物质的量(n)增大, c(H2)增大,平衡正向移动, CO2转化率增大 压强 正向移动 因为阳极发生 4OH--4e- =O2↑+2H2O,产生的 H+发生 H++HCO3-=H2O+CO2↑ HCO3-存在电离平衡: HCO3-
C+O2 -375 C 在恒容密闭容器中,随着氢气物质的量(n)增大, c(H2)增大,平衡正向移动, CO2转化率增大 压强 正向移动 因为阳极发生 4OH--4e- =O2↑+2H2O,产生的 H+发生 H++HCO3-=H2O+CO2↑ HCO3-存在电离平衡: HCO3-![]() H++CO32-,阴极 H+放电浓度减小平衡右移,CO32-再生(或阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生)
H++CO32-,阴极 H+放电浓度减小平衡右移,CO32-再生(或阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生)
【解析】(1)过程2中在700K条件下,二氧化碳和氧化亚铁发生反应生成碳和四氧化三铁;过程1中四氧化三铁在太阳能或>2300K时分解生成氧化亚铁和氧气,所以CO2为原料制取炭黑过程中的氧化亚铁做催化剂,根据反应物和生成物及反应条件书写化学方程式为:CO2![]() C+O2。
C+O2。
(2)△H=反应物总键能-生成物总键能,所以a=2×745.0×2+6×436.0-(615.0+4×413.4+4×462.8×2)=-375。
(3)根据化学平衡移动原理结合如图1所示,在恒容密闭容器中,随着氢气物质的量增大,c(H2)增大,平衡正向移动,CO2转化率增大,所以A、B、C三点对应的体系,CO的转化率最大的是C点。
(4)①由已知,该反应正向放热且气体分子数减小,所以升高温度CO的平衡转化率减小,增大压强CO的平衡转化率增大,结合如图2可得,横坐标x应为温度,S代表压强,且S1>S2。②已知300℃时反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡时,CO的平衡转化率为60%,列三段式得:
CH3OH(g)达到平衡时,CO的平衡转化率为60%,列三段式得:
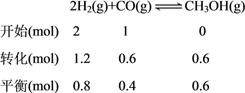 ,因为容器容积为10L,所以各物质平衡浓度为:c(H2)=0.08mol/L、c(CO)=0.04mol/L、c(CH3OH)=0.06mol/L,平衡常数K=
,因为容器容积为10L,所以各物质平衡浓度为:c(H2)=0.08mol/L、c(CO)=0.04mol/L、c(CH3OH)=0.06mol/L,平衡常数K=![]() =
=![]() =234.375;若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH若保持温度和容器休积不变,则此时c(H2)=0.28mol/L、c(CO)=0.24mol/L、c(CH3OH)=0.26mol/L,Q=
=234.375;若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH若保持温度和容器休积不变,则此时c(H2)=0.28mol/L、c(CO)=0.24mol/L、c(CH3OH)=0.26mol/L,Q=![]() =
=![]() ≈13.82<K=234.375,所以平衡会正向移动。
≈13.82<K=234.375,所以平衡会正向移动。
(5)①装置图中与电源正极相连的为电解池的阳极,与电源负极相连的为电解池的阴极,阳极上是氢氧根离子失电子生成氧气,电极反应为4OH--4e-=2H2O+O2↑,根据电荷守恒,水电离出的H+与HCO3-反应会产生CO2,离子方程式为:H++HCO3-=H2O+CO2↑。②HCO3-存在电离平衡:HCO3-![]() H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生;或者阴极H+放电破坏水的电离平衡,OH-浓度增大,OH-与HCO3-反应生成CO32-。
H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生;或者阴极H+放电破坏水的电离平衡,OH-浓度增大,OH-与HCO3-反应生成CO32-。



