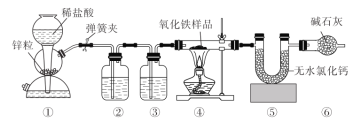
题目内容
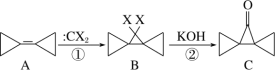
【题目】新药H的一种合成路线如图:
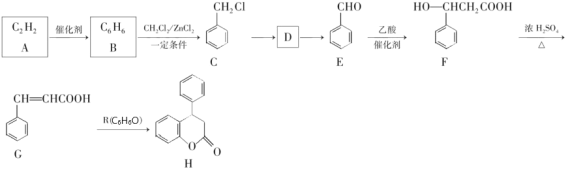
已知:A能使溴水褪色,R遇氯化铁溶液发生显色反应。
(1)R的名称是____________________;G中所含官能团名称是______________。
(2)C→D的反应条件和试剂是____________;E→F的反应类型是___________。
(3)能检验H含酯基的仪器名称是_________。A→B的原子利用率为___________。
(4)写出D→E的化学方程式:____________。
(5)在G的同分异构体中,同时满足下列条件的同分异构体有_______种。
①属于苯的衍生物;
②能发生水解反应和银镜反应;
③能与溴的四氯化碳溶液发生加成反应。
(6)参照上述合成路线,设计一条由乙烯、乙酸为原料制备![]() 的合成路线__________
的合成路线__________
【答案】苯酚 羧基、碳碳双键 氢氧化钠水溶液、加热 加成反应 红外光谱仪 100% 2![]() +O2
+O2![]() 2
2![]() +2H2O 5 CH2=CH2
+2H2O 5 CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br![]() HOCH2CH2OH
HOCH2CH2OH![]() OHC-CHO
OHC-CHO![]()
![]()
【解析】
由A的分子式以及其能使溴水褪色的性质可知,A为乙炔;由R的分子式以及其能遇到FeCl3发生显色反应的性质可知,R为苯酚;C的分子中含有苯环,C是由B反应得来,B的分子式为C6H6,所以推测B为苯;那么B生成C,发生的即取代反应;对比C和E的结构差异,推测C生成D发生的是卤代烃的水解反应,D为苯甲醇,D再被氧化生成E即苯甲醛;苯甲醛和乙酸反应后生成F(结构为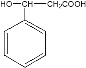 ),由F的结构可知,二者发生的是加成反应;对比F和G(结构为
),由F的结构可知,二者发生的是加成反应;对比F和G(结构为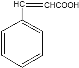 )的结构差异可知,F生成G的反应是消去反应;G最后再与苯酚反应生成产物H(结构为
)的结构差异可知,F生成G的反应是消去反应;G最后再与苯酚反应生成产物H(结构为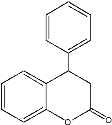 ),由G和H的结构可知,这步反应既涉及加成,又涉及取代。
),由G和H的结构可知,这步反应既涉及加成,又涉及取代。
(1)通过分析可知,R的名称为苯酚;由G的结构可知,其中所含的官能团名称为碳碳双键和羧基;
(2)通过分析可知,C生成D发生的是卤代烃的水解反应,反应条件和试剂是NaOH水溶液,加热;通过分析可知,E生成F的反应为加成反应;
(3)红外光谱仪可以确定有机物中的官能团种类;通过分析可知,A为乙炔,由乙炔生成苯的原子利用率为100%;
(4)通过分析可知,D生成E发生的即醇的催化氧化反应,方程式为:2![]() +O2
+O2![]() 2
2![]() +2H2O;
+2H2O;
(5)G为 ,不饱和度为6;其同分异构体是苯的衍生物,所以也含有苯环;其同分异构体既能发生水解反应,又能发生银镜反应,所以一定含有HCOO-;其同分异构体还能与溴的四氯化碳溶液发生加成,所以一定含有碳碳双键;综上所述,符合要求的同分异构体的结构有:
,不饱和度为6;其同分异构体是苯的衍生物,所以也含有苯环;其同分异构体既能发生水解反应,又能发生银镜反应,所以一定含有HCOO-;其同分异构体还能与溴的四氯化碳溶液发生加成,所以一定含有碳碳双键;综上所述,符合要求的同分异构体的结构有: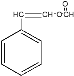 和
和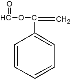 以及HCOO-和CH2=CH-分别在苯环上处于邻位,对位和间位的三种结构,共计5种结构;
以及HCOO-和CH2=CH-分别在苯环上处于邻位,对位和间位的三种结构,共计5种结构;
(6)由题可知,苯甲醛与乙酸能反应生成 ,所以乙二醛可以和乙酸反应生成
,所以乙二醛可以和乙酸反应生成![]() ,因此合成路线为:CH2=CH2
,因此合成路线为:CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br![]() HOCH2CH2OH
HOCH2CH2OH![]() OHC-CHO
OHC-CHO![]()
![]() 。
。