题目内容
【题目】以铬铁矿[主要成分为Fe(CrO2)2],含有Al2O3、Fe2O3、SiO2等杂质为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下,关于该流程说法错误的是( )
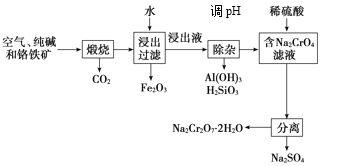
A.煅烧生成Na2CrO4的化学方程式为:4Fe(CrO2)2+8Na2CO3+7O2![]() 2Fe2O3+8Na2CrO4 +8CO2
2Fe2O3+8Na2CrO4 +8CO2
B.SiO2在“浸出过滤”步骤中和Fe2O3一起除去
C.Na2CrO4到Na2Cr2O7转化的原理为:2H++2CrO42-![]() Cr2O72-+H2O
Cr2O72-+H2O
D.该工艺中“煅烧”产生的CO2可用于“除杂”步骤以节约生产成本,为完全除去AlO2-,发生的离子反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
【答案】B
【解析】
A.根据流程可知,煅烧过程中反应物空气,纯碱(Na2CO3)和铁铬矿,产物有Fe2O3、Na2CrO4 和CO2,铬元素和铁元素被氧化,反应物中有空气,可推测氧化剂为氧气,根据电子守恒和元素守恒可知反应方程式为:![]() ,故A项正确;
,故A项正确;
B.煅烧过程中加入纯碱,高温条件下SiO2会与纯碱发生反应,故B项错误;
C.![]() ,加入稀硫酸会使平衡右移,生成Cr2O72-,故C项正确;
,加入稀硫酸会使平衡右移,生成Cr2O72-,故C项正确;
D.碳酸的酸性强于偏铝酸,可与AlO2-反应生成氢氧化铝沉淀,D项正确;
故答案为B。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】H2是一种重要的清洁能源。
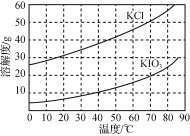
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。

(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。
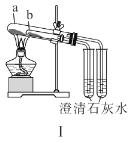
【题目】甲、乙两同学为探究![]() 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
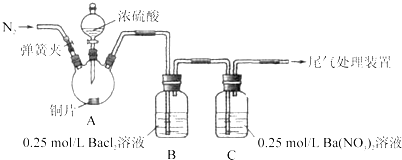
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡,B中有气泡冒出,产生大量白色沉淀,C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是_______,该沉淀的生成表明SO2具有_______性。
(3)C中液面上方生成浅棕色气体的化学方程式是______。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是____;乙在A、B间增加洗气瓶D,D中盛放的试剂是______。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____。