题目内容
1. 已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应.甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体.请回答下列问题.
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应.甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体.请回答下列问题.(1)G的化学式为:Na2CO3.
(2)①反应的化学方程式为:C+2H2SO4(浓)=△=CO2↑+2SO2↑+2H2O.
②反应的离子方程式为:2SO2+O2+2H2O=4H++2SO42-.
(3)③反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,每生成 1mol 乙气体,反应中转移2mol 电子.
分析 甲是常见的黑色固体单质,可为生产生活提供热能,可知甲是C,B是无色有刺激性气味的气体,是主要的大气污染物之一,为SO2气体,因此A为浓硫酸溶液,常温下,C是一种无色液体是水,D为CO2,二氧化硫和氧气和水反应生成硫酸,故乙为O2,水、二氧化碳均与E反应生成氧气,说明E为Na2O2,则F为NaOH,G为Na2CO3,
(1)上述分析可知G为碳酸钠;
(2)①反应是碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水;
②反应二氧化硫和氧气水发生的氧化还原反应生成硫酸;
(3)③反应是过氧化钠和水的反应生成氢氧化钠和氧气,化学方程式中生成1mol氧气电子转移2mol.
解答 解:甲是常见的黑色固体单质,可为生产生活提供热能,可知甲是C,B是无色有刺激性气味的气体,是主要的大气污染物之一,为SO2气体,因此A为浓硫酸溶液,常温下,C是一种无色液体是水,D为CO2,二氧化硫和氧气和水反应生成硫酸,故乙为O2,水、二氧化碳均与E反应生成氧气,说明E为Na2O2,则F为NaOH,G为Na2CO3,
(1)上述分析可知G为碳酸钠,化学式为Na2CO3,故答案为:Na2CO3;
(2)①反应是碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,反应的化学方程式为C+2H2SO4(浓)=△=CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)=△=CO2↑+2SO2↑+2H2O;
②反应二氧化硫和氧气水发生的氧化还原反应生成硫酸,反应的离子方程式为2SO2+O2+2H2O=4H++2SO42-,故答案为:2SO2+O2+2H2O=4H++2SO42-;
(3)③反应是过氧化钠和水的反应生成氢氧化钠和氧气,反应的离子方程式化学方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,反应中生成1mol乙为氧气电子转移2mol,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;2.
点评 本题考查无机物的推断,为高频考点,把握习题中物质的颜色、气味、与生活环境的关系及相互转化来推断各物质为解答的关键,侧重S及其化合物及Na及其化合物性质的考查,题目难度中等.

| A. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| B. | 高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有害 | |
| C. | 光导纤维中所用材料为晶体硅 | |
| D. | NOx、SO2、CO2、PM2.5颗粒都会导致酸雨 |
| A. | Al | B. | Cl | C. | Mg | D. | Si |
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(2)下列一组能减少酸雨产生的有效措施是B(填字母).
①少用煤作燃料 ②加大石油、煤炭的开采速度,增加化石燃料的供应量
③燃料脱硫 ④在已酸化的土壤中加入石灰 ⑤开发新能源
A.①②⑤B.①③⑤C.②③④D.③④⑤
(3)氯系消毒剂是目前使用最广泛的一类消毒剂.家庭使用漂白粉进行消毒时,可直接将漂白粉置于空气中,请写出反应的化学方程式Ca(ClO)2+CO2+H2O═CaCO3+2HClO.
| A. |  将NO2球浸泡在冷水中和热水中 | |
| B. | 排饱和食盐水收集氯气 | |
| C. | 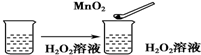 | |
| D. | N2+3H2?高温、高压催化剂2NH3△H<0工业合成氨,通常选择高压的条件 |
| A. | 1-丁烯和1,3-丁二烯 | B. | 己烷和环己烷 | ||
| C. | 尿素和氰酸铵(NH4CNO) | D. | 1,4-二甲苯和1,3,5-三甲苯 |
| A. | H2SO4 | B. | Zn | C. | ZnSO4 | D. | H2 |
| A. | NH4+ | B. | HCO3- | C. | SO42- | D. | Mg2+ |