题目内容
11.(1)在FeCl3溶液中存在下列平衡:FeCl3+3H2O?Fe(OH)3+3HCl△H>0,①不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体是Fe2O3
②在配置FeCl3溶液时,为防止产生浑浊,应向溶液中加入浓盐酸
(2)某温度下,纯水的c(H+)=3×10-7 mol/L,则此时c(OH-)=3×10-7mol/L,若温度不变 滴入稀盐酸使c(H+)=2×10-4mol/L,则溶液中的c(OH-)=4.5×10-10mol/L,此时温度高于(填“高于”“低于”或“等于”)25℃.
(3)按要求写出反应方程式:
①写出Ag2S沉淀的溶解平衡方程式:Ag2S(s)?2Ag+(aq)+S2-(aq)
②NaHCO3的电离方程式:NaHCO3=Na++HCO3-、HCO3-?H++CO32-.
分析 (1)①加热蒸干挥发性酸的氯化铁溶液时生成弱碱氢氧化铁,灼烧氢氧化铁时生成氧化铁和水;
②FeCl3水解生成氢氧化铁,为防止FeCl3水解加入酸;
(2)依据纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同;在酸溶液、碱溶液、盐溶液中存在离子积常数,Kw随温度变化;依据离子积计算离子浓度,水的电离是吸热过程,升温平衡正向进行;
(3)①Ag2S沉淀溶解平衡时可能过程,需要标注可逆性稀溶液和沉淀状态;
②NaHCO3电离生成钠离子和碳酸氢根离子,碳酸氢根离子电离生成碳酸根离子和氢离子.
解答 解:(1)①加热蒸干FeCl3溶液时,FeCl3水解生成氢氧化铁和HCl,加热促进HCl挥发,从而促进FeCl3水解,蒸干时得到氢氧化铁固体,灼烧氢氧化铁固体,氢氧化铁分解生成氧化铁和水,所以最终得到Fe2O3固体,故答案为:Fe2O3;
②FeCl3水解生成氢氧化铁和HCl,为防止氯化铁水解,向溶液中滴加浓盐酸即可,故答案为:浓盐酸;
(2)某温度下纯水中的C(H+)=3×10-7mol/L,则此时溶液中的C(OH-)=3×10-7mol/L;若温度不变,滴入稀盐酸,使C(H+)=2×10-4mol/L,溶液中则溶液中C(H+)×C(OH-)=9×10-14,C(OH-)=$\frac{9×1{0}^{-14}}{2×1{0}^{-4}}$=4.5×10-10mol/L,此时溶液中由水电离产生的C(H+)=4.5×10-10mol/L,水电离得到c(H+)=3×10-7 mol/L>10-7mol/L,说明水的电离被促进,温度高于25°C;
故答案为:3×10-7mol/L;4.5×10-10mol/L;高于;
(3)①Ag2S沉淀溶解平衡时可能过程,需要标注可逆性稀溶液和沉淀状态,沉淀溶解平衡为:Ag2S(s)?2Ag+(aq)+S2-(aq),
故答案为:Ag2S(s)?2Ag+(aq)+S2-(aq);
②NaHCO3电离生成钠离子和碳酸氢根离子,电离方程式为:NaHCO3=Na++HCO3-、HCO3-?H++CO32-,故答案为:NaHCO3=Na++HCO3-;HCO3-?H++CO32-.
点评 本题考查了盐类水解分析,影响水的电离平衡状态因素,水的离子积常数的理解应用,注意方程式的书写方法,掌握基础是关键,题目较简单.

| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中; 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3.将一小段镁带投入稀盐酸中; 4.将一小片铝投入稀盐酸中. |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不剧烈,产生无色气体 D.有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
①168O ②O2③188O ④O3 ⑤O4 ⑥O2- ⑦O22-.
| A. | ①③⑥ | B. | ②④⑤ | C. | ①②⑦ | D. | ④⑤⑦ |
| A. | NH4+、Na+、Cl-、OH- | B. | Fe2+、H+、NO3-、SO42- | ||
| C. | NH4+、K+、HCO3-、OH- | D. | Fe3+、NH4+、NO3-、SO42- |
| A. | 第一电离能的大小:Mg>Al | |
| B. | 锗的第一电离能高于碳而电负性低于碳 | |
| C. | Ni是元素周期表中第28号元素,第2周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳 | |
| D. | 元素的第一电离能:Al<Si |
| A. | <0.45mol | B. | 0.45mol | ||
| C. | 0.45-0.90mol之间 | D. | >0.90mol |

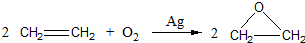
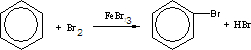 .
. 已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应.甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体.请回答下列问题.
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应.甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体.请回答下列问题.