题目内容
4.如图1为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):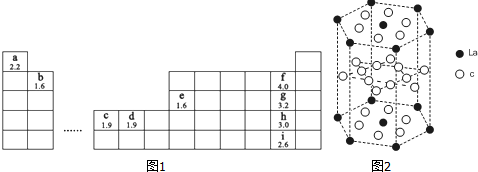
(1)b、h两元素可形成化合物bh2,写出其电子式:
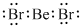 .
.(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为平面正三角形,eg3、e2g6中心原子e的杂化方式分别为sp2、sp3.
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式:Cu+4HCl=H2CuCl4+H2↑.
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 | f-f | g-g | h-h | i-i |
| 键能(kJ/mol) | 157 | 242.7 | 193.7 | 152.7 |
(5)c元素的元素符号是Ni,价电子排布式为3d84s2,下图是一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图2中勾画出该晶体的一个晶胞.计算出该合金的化学式为:LaNi5.
分析 由元素在周期表中位置,可知a为H,b为Be,c为Ni,d为Cu,e为Al,f为F,g为Cl、h为Br、i为I.
(1)b、h两元素电负性之差小于1.7,二者形成化合物BeBr2属于共价化合物,Be原子与Br原子之间形成1对共用电子对;
(2)计算AlCl3的分子Al原子的价层电子对数、孤电子对数,进而确定空间构型与杂化方式;
Al2Cl6中心原子Al形成4个σ键(其中1个为配位键),没有孤电子对;
(3)可燃性气体为氢气,由于HCl浓溶液,配合物为H2CuCl4;
(4)F原子半径较小,价电子较多,导致电子云密度增大,极大增加了两原子间的排斥作用;
(5)c为Ni,原子核外由28个电子,根据能量最低原理书写价电子排布式;晶胞采取平行六面体,是晶体的基本重复单元,晶胞通过无隙并置形成晶体;利用均摊法计算图中六棱体中La原子、Ni原子数目,确定化学式.
解答 解:由元素在周期表中位置,可知a为H,b为Be,c为Ni,d为Cu,e为Al,f为F,g为Cl、h为Br、i为I.
(1)b、h两元素电负性之差小于1.7,二者形成化合物BeBr2属于共价化合物,Be原子与Br原子之间形成1对共用电子对.其电子式为: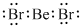 ,故答案为:
,故答案为: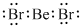 ;
;
(2)AlCl3的分子Al原子的价层电子对数=3+$\frac{3-1×3}{2}$=3,没有孤电子对,故其空间构型为平面正三角形,Al原子采取sp2杂化,而Al2Cl6中心原子Al形成4个σ键(其中1个为配位键),没有孤电子对,采取sp3杂化,故答案为:平面正三角形;sp2;sp3;
(3)可燃性气体为氢气,由于HCl浓溶液,配合物为H2CuCl4,反应方程式为:Cu+4HCl=H2CuCl4+H2↑,
故答案为:Cu+4HCl=H2CuCl4+H2↑;
(4)F原子半径较小,价电子较多,导致电子云密度增大,极大增加了两原子间的排斥作用,故键能较小,共价键易断裂,
故答案为:F原子半径较小,价电子较多,导致电子云密度增大,极大增加了两原子间的排斥作用,故键能较小,共价键易断裂;
(5)c为Ni,原子核外由28个电子,根据能量最低原理,可知价电子排布式为3d84s2;晶胞采取平行六面体,是晶体的基本重复单元,晶胞通过无隙并置形成晶体,画出该晶体的一个晶胞如图: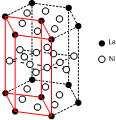 ;图2中六棱体中La原子数目=12×$\frac{1}{6}$+2×$\frac{1}{2}$=3,六棱体中Ni原子数目=6+12×$\frac{1}{2}$+6×$\frac{1}{2}$=15,化学式为LaNi5,
;图2中六棱体中La原子数目=12×$\frac{1}{6}$+2×$\frac{1}{2}$=3,六棱体中Ni原子数目=6+12×$\frac{1}{2}$+6×$\frac{1}{2}$=15,化学式为LaNi5,
故答案为:Ni;3d84s2; ;LaNi5.
;LaNi5.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、空间构型、配合物、晶胞结构与计算等,是对学生综合能力的考查,难度较大.

 名校课堂系列答案
名校课堂系列答案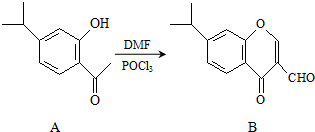 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )| A. | 分子A中所有碳原子均位于同一平面 | |
| B. | 用FeCl3溶液可检验物质B中是否混有A | |
| C. | 物质B既能发生银镜反应,又能发生水解反应 | |
| D. | 1mol B最多可与5mol H2发生加成反应 |
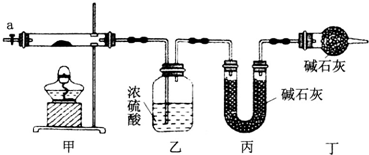
(1)按如图所示装置组装好仪器,并检查装置气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生时(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取COCl2•6H2O的一种工艺如下:

已知;25℃时
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.
| A. | 催化剂的使用,可以降低反应的温度,起到节能的效果 | |
| B. | 陶瓷刀大多是用一种纳米材料“氧化锆”为原料加工而成,具有硬度高、导热性好、抗腐蚀等优点 | |
| C. | 石墨烯是一种由碳原子构成的单层片状结构的新材料,因此具有巨大的表面积,通过穿透式电子显微镜可用于直接观测单原子的吸附和释放过程 | |
| D. | 推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2、PM2.5,使天空重现“蔚蓝” |
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| C. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
| A. | 溶液一定呈酸性 | B. | 溶液中一定存在:Y2-+H2O?OH-+HY- | ||
| C. | 溶液加水稀释,离子浓度都减小 | D. | 溶液中:c(Na+)≥c(Y2-) |
| A. | 导致易拉罐变瘪的离子反应是CO2+OH-=HCO3- | |
| B. | 导致易拉罐又鼓起来的反应是Al3++3HCO3-=Al(OH)3+3CO2↑ | |
| C. | 上述过程中共发生了三个化学反应,且反应结束后的溶液呈碱性 | |
| D. | 若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象 |
| A. | I A族和ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 因H2SO3的酸性比H2CO3强,所以S的非金属性比C强 | |
| C. | H2O2、CH3CH3、Cl-、K+中的电子数和质子数均分别相等 | |
| D. | Na+、Al3+、O2-、F-的半径逐渐减小 |
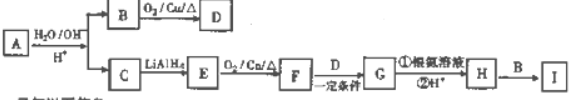
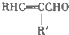 +H2O
+H2O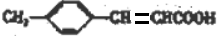 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$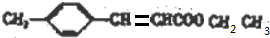 +H2O,反应类型为取代反应(酯化反应).
+H2O,反应类型为取代反应(酯化反应).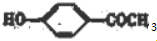 (写结构简式).
(写结构简式).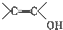 )结构.
)结构.