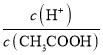题目内容
【题目】下表中依据热化学方程式得到的对应结论正确的是
热化学方程式 | 结论 | |
A | 稀溶液中:H+(aq)+OH-(aq)=H2O (l) △H=-57.3kJ.mol-1 | 将稀硫酸与氢氧化钡溶液混合后,若有1molH2O 生成,则放出的能量为57.3kJ |
B | Sn(s,灰) | 锡制品在炎热的夏天更容易损坏 |
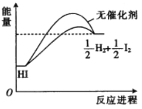
C | P4(s,白磷)=4P(s,红磷) △H=-29.2kJ.mol-1 | 常温下红磷比白磷更稳定 |
D | C3H8(g)+5O2(g)=3CO2 (g)+4H2O(g) △H=-2043.9kJ.mol-1 | C3H8的燃烧热△H=-2043.9kJ.mol-1 |
A.AB.BC.CD.D
【答案】C
【解析】
A.因SO42-、Ba2+反应生成BaSO4时放出热量,则将稀硫酸与氢氧化钡溶液混合后,若有1molH2O 生成,放出的能量大于57.3kJ,故A错误;
B.焓变为正,可知灰锡能量低较稳定,则锡制品在寒冷的冬天更容易损坏,故B错误;
C.能量低的稳定,由P4(s,白磷)=4P(s,红磷) △H=-29.2kJ.mol-1可知红磷的能量低,稳定,故C正确;
D.燃烧热中生成液态水,热化学方程式中生成气态水,则不能确定C3H8燃烧热,故D错误;
故答案为C。

练习册系列答案
相关题目