题目内容
【题目】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中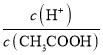 值增大的措施是_______________(填序号)。
值增大的措施是_______________(填序号)。
a.加水稀释b.加入少量CH3COONa固体 c.加入少量冰醋酸d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b=_________。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________;该混合溶液中:c(A-)-c(Na+)=______________________mol/L(填数值)。
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种溶液pH由小到大的顺序为:_______________________________(填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)_____c(CO32-)(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银分别放入:
a.100mL蒸馏水中;
b.100mL0.2mol/LAgNO3溶液中;
c.100mL0.1mol/L氯化铝溶液中;
d.100mL0.1mol/L盐酸溶液中。
充分搅抖后,相同温度下银离子浓度由大到小的顺序是________________(填写序号);b中氯离子的浓度为_________________。
【答案】a、d、f 14 HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA,可继续电离出H+,使溶液的pH=5 9.9×10-6或10-5-10-7 c<a<b > b>a>d>c 9×10-10mol/L
【解析】
(1)a.加水稀释醋酸,c(H+)、c(CH3COOH)均减小,但由于促进了醋酸的电离,c(CH3COOH)减少量大于c(H+),所以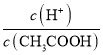 值增大,a项正确;
值增大,a项正确;
b.加CH3COONa固体,由于CH3COO-对CH3COOH的电离起着抑制作用,则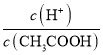 值减小,b项错误;
值减小,b项错误;
c. 加入少量冰醋酸,醋酸浓度增大,弱电解质的浓度越大,电离程度越小,则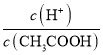 值减小,c项错误;
值减小,c项错误;
d. 通入少量HCl气体,溶液中的c(H+)明显增大,平衡左移,c(CH3COOH)略微增大,则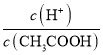 值增大,d项正确;
值增大,d项正确;
e. 加少量烧碱溶液,溶液中的c(H+)明显减小,平衡右移,c(CH3COOH)略微减小,则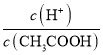 值减小,e项错误;
值减小,e项错误;
f. 升高温度,平衡右移,则c(H+)增大,c(CH3COOH)减小,所以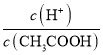 值增大,f项正确;
值增大,f项正确;
故选adf;
(2)①若100体积pH=a的H2SO4溶液中氢离子的物质的量浓度为10-amol/L,1体积pH=b的NaOH溶液中氢氧根离子的物质的量浓度为10b-12mol/L,混合溶液呈中性,则n(H+)=n(OH-),即100×10-amol/L=1×10b-12mol/L,所以a+b=14;
②pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,若恰好完全反应,如果酸是强酸,则盐溶液呈中性,实际上溶液呈酸性,则HA为弱酸,HA与NaOH反应后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5;该溶液中存在电荷守恒为c(A-)+c(OH-)=c(Na+)+c(H+),则c(A-)-c(Na+)= c(H+)-c(OH-)=(10-5-10-7)mol/L=9.9×10-6mol/L;
(3)已知酸性的强弱顺序为:CH3COOH>H2CO3>HClO;
①弱酸的酸性越弱,则对应的酸根离子水解程度越大,浓度相等时溶液的碱性越强,三种溶液pH由小到大的顺序为c<a<b;
②NaHCO3溶液的pH大于8 显碱性,HCO3-的水解程度大于其电离程度,则溶液中c(H2CO3)>c(CO32-);
(4)a.100mL蒸馏水中,c(Ag+)=![]() =1.34×10-5mol/L;
=1.34×10-5mol/L;
b. 100mL0.2mol/LAgNO3溶液中c(Ag+)为0.2mol/L,抑制沉淀溶解平衡;
c. 100mL0.1mol/L氯化铝溶液中c(Cl-)为0.3mol/L,则c(Ag+)=6×10-10mol/L;
d. 100mL0.1mol/L盐酸溶液中c(Cl-)为0.1mol/L,则c(Ag+)=1.8×10-9mol/L;
综上银离子浓度大小顺序为b>a>d>c;
b中100mL0.2mol/LAgNO3溶液中c(Ag+)为0.2mol/L,故c(Cl-)=![]() mol/L=9×10-10mol/L。
mol/L=9×10-10mol/L。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】下表中依据热化学方程式得到的对应结论正确的是
热化学方程式 | 结论 | |
A | 稀溶液中:H+(aq)+OH-(aq)=H2O (l) △H=-57.3kJ.mol-1 | 将稀硫酸与氢氧化钡溶液混合后,若有1molH2O 生成,则放出的能量为57.3kJ |
B | Sn(s,灰) | 锡制品在炎热的夏天更容易损坏 |
C | P4(s,白磷)=4P(s,红磷) △H=-29.2kJ.mol-1 | 常温下红磷比白磷更稳定 |
D | C3H8(g)+5O2(g)=3CO2 (g)+4H2O(g) △H=-2043.9kJ.mol-1 | C3H8的燃烧热△H=-2043.9kJ.mol-1 |
A.AB.BC.CD.D