题目内容
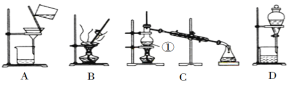
【题目】为了验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)

实验过程:
Ⅰ.打开弹簧夹,打开活塞 a,滴加浓盐酸
Ⅱ.当 B 和 C 中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当 B 中溶液由黄色变为棕红色时,关闭活塞 a
Ⅳ.…
(1)A 中反应的化学方程式为:____KMnO4+_____HCl(浓)═____ KCl+____MnCl2+____Cl2↑+____H2O,则氧化性 KMnO4________Cl2(填“>”“<”或“=”).
(2)验证氯气的氧化性强于碘的实验现象是__________
(3)过程Ⅲ的实验目的是__________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________。
(5)浸有 NaOH溶液的棉花团的作用是__________。此处发生 的化学方程式是__________。
(6)氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl- < Br- < CN- < SCN- < I-。试写出:
a.(CN)2 与 KOH 反应的化学方程式__________;
b.在 NaBr 和 KSCN 的混合溶液中加入(CN)2 的离子方程式__________。
【答案】2 16 2 2 5 8 > 湿润的淀粉KI试纸变蓝 确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D,振荡,静置后CCl4层溶液变为紫红色 处理尾气,防止污染环境 2NaOH + Cl2 = NaCl + NaClO +H2O 2KOH + (CN)2 = KCN + KCNO +H2O (CN)2 + 2SCN- = (SCN)2+ 2CN-
【解析】
A中高锰酸钾与浓盐酸反应得到氯气,氯气将碘离子氧化为碘单质,淀粉遇碘显蓝色可以证明碘单质的生成,B、C中氯气将溴离子氧化为黄色的溴单质,氯气将C中的溴离子完全氧化为溴单质,注意排除氯气的干扰,再将C加入D,溴单质将D中碘离子氧化得到碘单质,振荡试管发生萃取,四氯化碳中显示紫红色;根据Cl2与KOH反应类比(CN)2与KOH反应,根据还原性:CN- < SCN-,则氧化性为Br2 > (CN)2 > (SCN)2,得出KSCN和(CN)2反应。
(1)根据化合价升降相等,得出A 中反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,氧化剂氧化性大于氧化产物氧化性,因此氧化性 KMnO4>Cl2,故答案为:2;16;2;2;5;8;>。
(2) 氯气遇到淀粉KI试纸时,发生反应2KI+Cl2=2KCl+I2,生成的碘单质可以使湿润的淀粉试纸变蓝,由此证明氯气的氧化性强于碘,故答案为:湿润的淀粉KI试纸变蓝。
(3) 氯气也能氧化溴离子,验证溴置换碘时应排除氯气的干扰,故过程Ⅲ实验的目的是确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;故答案为:确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D,振荡,静置后CCl4层溶液变为紫红色;故答案为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D,振荡,静置后CCl4层溶液变为紫红色。
(5)浸有 NaOH溶液的棉花团的作用是处理尾气,防止污染环境。此处发生的化学方程式是2NaOH + Cl2 = NaCl + NaClO +H2O;故答案为:处理尾气,防止污染环境;2NaOH + Cl2 = NaCl + NaClO +H2O。
(6)a. 根据阴离子的还原性强弱为:Cl- < Br- < CN- < SCN- < I-,(CN)2与KOH 反应的化学方程式2KOH + (CN)2 = KCN + KCNO +H2O;故答案为:2KOH + (CN)2 = KCN + KCNO +H2O。
b. 还原性:CN- < SCN-,则氧化性为Br2 > (CN)2 > (SCN)2,因此在 NaBr 和 KSCN的混合溶液中加入(CN)2的离子方程式 (CN)2 + 2SCN- = (SCN)2+ 2CN-;故答案为:(CN)2 + 2SCN- = (SCN)2+ 2CN-。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】下表中依据热化学方程式得到的对应结论正确的是
热化学方程式 | 结论 | |
A | 稀溶液中:H+(aq)+OH-(aq)=H2O (l) △H=-57.3kJ.mol-1 | 将稀硫酸与氢氧化钡溶液混合后,若有1molH2O 生成,则放出的能量为57.3kJ |
B | Sn(s,灰) | 锡制品在炎热的夏天更容易损坏 |
C | P4(s,白磷)=4P(s,红磷) △H=-29.2kJ.mol-1 | 常温下红磷比白磷更稳定 |
D | C3H8(g)+5O2(g)=3CO2 (g)+4H2O(g) △H=-2043.9kJ.mol-1 | C3H8的燃烧热△H=-2043.9kJ.mol-1 |
A.AB.BC.CD.D