题目内容
【题目】(1)红热木炭与浓H2SO4反应的化学方程式是C+2H2SO4![]() CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作___(填“氧化剂”或“还原剂”)。
CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作___(填“氧化剂”或“还原剂”)。
(2)SO2能够使品红溶液褪色,体现了二氧化硫具有___性。
(3)为了探究HClO的漂白性,某同学设计了如下的实验。
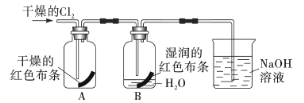
通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是___,从集气瓶B中湿润的红色布条的现象可得出的结论是___,其中发生的反应是___。
【答案】氧化剂 漂白 干燥的氯气不具有漂白性 氯气在有水的存在的情况下具有漂白性 Cl2+H2O=HCl+HClO
【解析】
(1)该反应中硫酸中S元素的化合价降低,所以浓硫酸的作用是氧化剂;
(2)SO2能够使品红溶液褪色,体现了二氧化硫具有漂白性;
(3)干燥的红色布条不褪色,说明干燥的氯气不具有漂白性;湿润的布条褪色说明氯气在有水的存在的情况下具有漂白性,发生反应Cl2+H2O=HCl+HClO。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
【题目】下表中依据热化学方程式得到的对应结论正确的是
热化学方程式 | 结论 | |
A | 稀溶液中:H+(aq)+OH-(aq)=H2O (l) △H=-57.3kJ.mol-1 | 将稀硫酸与氢氧化钡溶液混合后,若有1molH2O 生成,则放出的能量为57.3kJ |
B | Sn(s,灰) | 锡制品在炎热的夏天更容易损坏 |
C | P4(s,白磷)=4P(s,红磷) △H=-29.2kJ.mol-1 | 常温下红磷比白磷更稳定 |
D | C3H8(g)+5O2(g)=3CO2 (g)+4H2O(g) △H=-2043.9kJ.mol-1 | C3H8的燃烧热△H=-2043.9kJ.mol-1 |
A.AB.BC.CD.D