题目内容
【题目】从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. ①②③步骤的目的是从海水中获取MgCl2
C. 第④步电解得到,镁的方程式为MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
D. 提取镁的过程涉及化合、分解、置换反应
【答案】D
【解析】
海水中提取镁的步骤:碳酸钙高温分解为氧化钙,氧化钙溶于水生成氢氧化钙,氢氧化钙加入到海水中,镁离子与氢氧化钙反应生成氢氧化镁沉淀,富集镁元素;然后加入盐酸溶解氢氧化镁变为氯化镁溶液,氯化镁溶液经蒸发浓缩、冷却结晶、过滤等得到氯化镁晶体,在不断通入氯化氢气流的情况下,加热蒸干得到无水氯化镁,最后电解熔融的氯化镁得到金属镁,据以上分析解答。
根据题干信息可知有关的反应为CaCO3![]() CaO+CO2↑,CaO+H2O=Ca(OH)2,Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓,Mg(OH)2+2HCl=2H2O+MgCl2,MgCl2(熔融)
CaO+CO2↑,CaO+H2O=Ca(OH)2,Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓,Mg(OH)2+2HCl=2H2O+MgCl2,MgCl2(熔融)![]() Mg+Cl2↑,则:
Mg+Cl2↑,则:
A.根据有关原理可知此法的优点之一是原料贝壳、海水来源丰富,A正确;
B.由方程式可看出前三步目的就是为了从海水中获得制取Mg的原料MgCl2,B正确;
C.由上可知电解MgCl2得到镁的方程式MgCl2(熔融)![]() Mg+Cl2↑,C正确;
Mg+Cl2↑,C正确;
D.根据有关原理可判断提取镁的过程涉及化合、分解、复分解反应,但没有发生置换反应,D错误;
综上所述,本题选D。

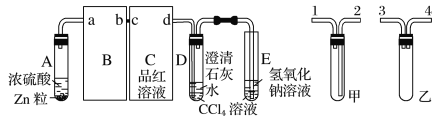
【题目】为探究Na 与CO2反应产物,某化学兴趣小组按下图装置进行实验。
已知:CO + 2Ag ( NH3) 2OH=2Ag↓+( NH4 ) 2CO3 +2NH3

回答下列问题:
(1)写出A 中反应的离子方程式__________________________。
(2)仪器X 的名称是_____________,B 中的溶液为________________。
(3)先称量硬质玻璃管的质量为m1 g ,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g 。再进行下列实验操作,其正确顺序是________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入CO2至E 中出现浑浊
e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g 。
(4)加热硬质玻璃管一段时间,观察到以下现象
① 钠块表面变黑,熔融成金属小球;
② 继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③ F 中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________。
(5)探究固体产物中元素Na 的存在形式
假设一:只有Na2CO3;假设二:只有Na2O ;假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤 | 假设一成立 |
2 | 往步骤1所得滤液中___________________________ | |
3 | _____________________________________________ |
(6)根据上述实验现象及下表实验数据,写出Na 与CO2反应的总化学方程式___________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |