题目内容
3.X、Y、Z、W代表短周期的四种元素,有关它们的部分结构及性质信息如下表所示.| 元素 | 部分结构信息 | 部分性质信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等; |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X的气态氢化物分子的电子式是
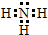 ;
;(2)Z元素在周期表中的位置是第三周期ⅦA族;
(3)X、Y、Z三元素的最高价氧化物对应水化物的酸性,由强到弱的顺序是(用化学式表示)HClO4>HNO3>H2CO3;
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)写出Z的单质与二氧化硫的混合气体通入水中的离子反应方程式:Cl2+SO2+2H2O═4H++2Cl-+SO42-.
分析 X、Y、Z、W是短周期的四种元素,X的单质由双原子分子构成,分子中有14个电子,其质子数为7,X有多种氧化物,如XO、XO2、X2O4等,所以X为N元素;
Y原子的次外层电子数等于最外层电子数的一半,Y能形成多种气态氢化物,则Y为C元素;
Z原子的最外层电子数多于4,非金属元素,Z元素的最高正化合价与最低负化合价代数和等于6,其最高价为+7价,为Cl元素;
W原子的最外层电子数等于2n-3(n为原子核外电子层数),化学反应中W原子易失去最外层电子形成Wn+,n=3符合,则W为Al,据此进行解答.
解答 解:X、Y、Z、W是短周期的四种元素,X的单质由双原子分子构成,分子中有14个电子,其质子数为7,X有多种氧化物,如XO、XO2、X2O4等,所以X为N元素;Y原子的次外层电子数等于最外层电子数的一半,Y能形成多种气态氢化物,则Y为C元素;Z原子的最外层电子数多于4,非金属元素,Z元素的最高正化合价与最低负化合价代数和等于6,其最高价为+7价,为Cl元素;W原子的最外层电子数等于2n-3(n为原子核外电子层数),化学反应中W原子易失去最外层电子形成Wn+,n=3符合,则W为Al,
(1)X为N元素,其气态氢化物为氨气,氨气为共价化合物,分子中含有3个氮氢键,氨气的电子式为: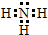 ,
,
故答案为: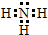 ;
;
(2)Z为Cl元素,其原子序数为17,位于周期表中第三周期ⅦA族,
故答案为:第三周期ⅦA族;
(3)非金属性Cl>N>C,则最高价含氧酸的酸性为强弱为:HClO4>HNO3>H2CO3,
故答案为:HClO4>HNO3>H2CO3;
(4)实验室用X的氢化物的水溶液为氨水,W的氢氧化物为氢氧化铝,氨水与铝离子反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)Z的单质为氯气,氯气与二氧化硫在溶液中反应生成硫酸和氯化氢,反应的离子反应方程式为:Cl2+SO2+2H2O═4H++2Cl-+SO42-,
故答案为:Cl2+SO2+2H2O═4H++2Cl-+SO42-.
点评 本题考查结构性质与位置关系的综合应用,题目难度中等,推断元素是解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题侧重考查学生的分析、理解能力及灵活应用能力.

| A. | 硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 将Cl2通入KI溶液中:2I-+Cl2═2Cl-+I2 | |
| D. | 硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| A. | 5.6L N2和11g CO2 | B. | 5g CO和5g H2 | ||
| C. | 含1mol H原子的H2O和0.5mol Br2 | D. | 质子数相等的NH3和HCl |
| A. | 澄清石灰水中加入盐酸:Ca(OH)2+2H+═2H2O+Ca2+ | |
| B. | 硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| C. | 碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 铁与氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |
| A. | C4H8 | B. | C2H4 | C. | C2H2 | D. | CH4 |
| A. | 物质{混合物纯净物{溶液化合物 | B. |  | ||
| C. |  | D. |  |
| A. | NaOH、H2 | B. | Fe、NaCl | C. | Fe(OH)3、NaCl、H2 | D. | H2、NaCl、NaOH |