题目内容
9.下列各组物质中所含分子数一定相同的是( )| A. | 5.6L N2和11g CO2 | B. | 5g CO和5g H2 | ||
| C. | 含1mol H原子的H2O和0.5mol Br2 | D. | 质子数相等的NH3和HCl |
分析 各组物质中所含分子数一定相同,则各物质具有相同的物质的量;
A.没有明确氮气的所处温度、压强;
B.二者摩尔质量不同,根据n=$\frac{m}{M}$可知,二者物质的量不等;
C.含1mol H原子的H2O为0.5mol;
D.NH3中10个质子,HCl中有18个质子.
解答 解:A.11g CO2为0.25mol,没有明确氮气的所处温度、压强,5.6L N2不一定为0.25mol,故A错误;
B.CO、氢气摩尔质量不同,根据n=$\frac{m}{M}$可知,5g CO和5g H2物质的量不等,故B错误;
C.含1mol H原子的H2O为0.5mol,与0.5mol Br2含有相同分子数目,故C正确;
D.NH3中10个质子,HCl中有18个质子,质子数相等的NH3和HCl含有分子数目不相等,故D错误,
故选C.
点评 本题考查物质的量有关计算,比较基础,注意A选项中气体摩尔体积的使用条件与对象.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | SiO2能和水发生化合反应生成硅酸 | |
| B. | SiO2是酸性氧化物,它不溶于任何酸 | |
| C. | SiO2的俗名叫水玻璃,不溶于水 | |
| D. | SiO2又叫水晶,能溶于NaOH溶液中 |
3.下列各物质在溶液中能大量共存且形成无色溶液的是( )
| A. | NaCl BaCl2 Na2CO3 | B. | KNO3 HCl CaCl2 | ||
| C. | H2SO4 FeCl3 NaNO3 | D. | NaOH HNO3 NH4NO3 |
17.下列化学方程式改写成离子方程式正确的是( )
| A. | 2NaOH+Cl2═NaCl+NaClO+H2O; Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | CaCO3+2HCl═CaCl2+CO2↑+H2O; CO32-+2H+═CO2↑+H2O | |
| C. | Al2(SO4)3+6NH3•H2O═2 Al(OH)3↓+3(NH4)2SO4;Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O; 2H++2OH-═2H2O |
4.${\;}_{92}^{235}$U是制造原子弹的材料.${\;}_{92}^{235}$U的原子核内的中子数与核外电子数之差是( )
| A. | 235 | B. | 143 | C. | 92 | D. | 51 |
14.F2、Cl2、Br2、I2的顺序,下列变化规律中不正确的是( )
a.单子颜色逐渐加深
b.密度呈增大趋势
c.熔点与沸点逐渐升高
d.X2的氧化性增强
e.HX稳定性减弱
f.X-还原性减弱
g.与H2反应逐渐困难
h.与水反应逐渐困难.
a.单子颜色逐渐加深
b.密度呈增大趋势
c.熔点与沸点逐渐升高
d.X2的氧化性增强
e.HX稳定性减弱
f.X-还原性减弱
g.与H2反应逐渐困难
h.与水反应逐渐困难.
| A. | ac | B. | be | C. | df | D. | gh |
1.下列说法中正确的是( )
| A. | 标准状况下,22.4L H2所含原子数目为NA | |
| B. | 1mol铁与足量盐酸反应,转3mol电子 | |
| C. | 1L0.5mol•L-1Al2(SO4)3溶液中,Al3+的浓度为1.0mol•L-1 | |
| D. | 1.8g NH4+所含的电子数目为NA |
3.X、Y、Z、W代表短周期的四种元素,有关它们的部分结构及性质信息如下表所示.
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答):
(1)X的气态氢化物分子的电子式是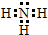 ;
;
(2)Z元素在周期表中的位置是第三周期ⅦA族;
(3)X、Y、Z三元素的最高价氧化物对应水化物的酸性,由强到弱的顺序是(用化学式表示)HClO4>HNO3>H2CO3;
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)写出Z的单质与二氧化硫的混合气体通入水中的离子反应方程式:Cl2+SO2+2H2O═4H++2Cl-+SO42-.
| 元素 | 部分结构信息 | 部分性质信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等; |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X的气态氢化物分子的电子式是
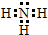 ;
;(2)Z元素在周期表中的位置是第三周期ⅦA族;
(3)X、Y、Z三元素的最高价氧化物对应水化物的酸性,由强到弱的顺序是(用化学式表示)HClO4>HNO3>H2CO3;
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)写出Z的单质与二氧化硫的混合气体通入水中的离子反应方程式:Cl2+SO2+2H2O═4H++2Cl-+SO42-.
4.下列化学方程式或离子方程式正确的是( )
| A. | 用醋酸去除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 乙醛与新制Cu(OH)2浊液反应:NaOH+CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| C. | 实验室用液溴和苯在催化剂作用下制溴苯: +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$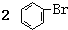 | |
| D. | 将CO2通入苯酚钠溶液: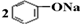 +CO2+H2O→ +CO2+H2O→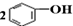 +Na2CO3 +Na2CO3 |