题目内容
15.(1)下列△H表示物质燃烧热的是△H4、△H5,表示物质中和热的是△H6、△H8(填△H1、△H2、△H3等).A.2H2(g)+O2(g)═2H2O(l);△H1
B.C(s)+$\frac{1}{2}$O2(g)═CO(g);△H2
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H3
D.C(s)+O2(g)═CO2(g);△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H5
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H6
G.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l);△H7
H.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l);△H8
(2)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应的燃烧热化学反应方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l),△H=-1294.8KJ/mol;
(3)充分燃烧一定量的丁烷放出的热量大小为QkJ,生成的CO2恰好与5mol/L 100ml KOH溶液完全反应生成酸式盐,则完全燃烧1mol丁烷的反应热△H为-8QkJ/mol.
分析 (1)1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热;中和热是酸碱的稀溶液反应生1nolH2O放出的热量;
(2)根据2.00g C2H2气体完全燃烧生成液态水和CO2,放出99.6kJ的热量,计算1molC2H2燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(3)CO2恰好与KOH溶液完全反应生成正盐为K2CO3,根据n=cV计算KOH的物质的量,根据钾元素守恒计算n(K2CO3),根据碳元素守恒由n(CO2)=n(K2CO3),进而计算丁烷的物质的量;CO2恰好与KOH溶液完全反应生成酸式盐为KHCO3,根据n=cV计算KOH的物质的量,根据钾元素守恒计算n(KHCO3),据碳元素守恒由n(CO2)=n(KHCO3),进而计算丁烷的物质的量,据此计算.
解答 解:(1)A、2mol氢气燃烧的焓变不是燃烧热,故不选;
B、C燃烧生成CO不是稳定的氧化物,故不选;
C、生成的水不是液态,是水蒸气,故不选;
D、符合燃烧热的概念,故选;
E、符合燃烧热的概念,故选;
F、符合中和热的概念,故选;
G、生成2mol水,不是中和热,故不选;
H、符合中和热的概念,故选;
故答案为:△H4、△H5;△H6、△H8;
(2)C2H2气体完全燃烧反应的化学方程式为:2C2H2+5O2$\stackrel{点燃}{→}$4CO2+2H2O,2.00g C2H2气体n(C2H2)=$\frac{2g}{26g/mol}$=$\frac{1}{13}$mol,放出99.6kJ的热量,则1molC2H2燃烧放出的热量为:99.6kJ×13=1294.8KJ,
则热化学方程式为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l),△H=-1294.8KJ/mol;
故答案为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l),△H=-1294.8KJ/mol;
(3)KOH的物质的量为0.1L×5mol/L=0.5mol,生成酸式盐是KHCO3,据钾离子守恒,n(KHCO3)=0.5mol,根据碳元素守恒由n(CO2)=n(KHCO3)=0.5mol,根据碳元素守恒可知,n(C4H10)=$\frac{1}{4}$n(CO2)=0.5mol×$\frac{1}{4}$=0.125mol,即0.125mol丁烷放出的热量大小为QkJ,故1mol丁烷完全燃烧放出的热量为QkJ×8=8QkJ;
1mol丁烷完全燃烧的反应热△H=-8QkJ/mol,
故答案为:-8Q kJ/mol.
点评 本题考查了燃烧热和中和热、热化学方程式书写、反应热的计算,难度中等,易错题为(3),根据产物计算丁烷的物质的量是解答该题的关键.

| A. | NaCl BaCl2 Na2CO3 | B. | KNO3 HCl CaCl2 | ||
| C. | H2SO4 FeCl3 NaNO3 | D. | NaOH HNO3 NH4NO3 |
| A. | 标准状况下,22.4L H2所含原子数目为NA | |
| B. | 1mol铁与足量盐酸反应,转3mol电子 | |
| C. | 1L0.5mol•L-1Al2(SO4)3溶液中,Al3+的浓度为1.0mol•L-1 | |
| D. | 1.8g NH4+所含的电子数目为NA |
| 元素 | 部分结构信息 | 部分性质信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等; |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X的气态氢化物分子的电子式是
 ;
;(2)Z元素在周期表中的位置是第三周期ⅦA族;
(3)X、Y、Z三元素的最高价氧化物对应水化物的酸性,由强到弱的顺序是(用化学式表示)HClO4>HNO3>H2CO3;
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)写出Z的单质与二氧化硫的混合气体通入水中的离子反应方程式:Cl2+SO2+2H2O═4H++2Cl-+SO42-.
| A. | pH=7的溶液 | |
| B. | c(H+)=c(OH-)=10-6mol/L溶液 | |
| C. | c(H+)═10-7mol/L | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
| A. | 用醋酸去除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 乙醛与新制Cu(OH)2浊液反应:NaOH+CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| C. | 实验室用液溴和苯在催化剂作用下制溴苯: +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ | |
| D. | 将CO2通入苯酚钠溶液: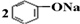 +CO2+H2O→ +CO2+H2O→ +Na2CO3 +Na2CO3 |
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | MgO的熔点比MgCl2高主要是因为MgO的晶格能比MgCl2大 |
 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.
X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.