题目内容
12.将少量金属钠投入到氯化铁溶液中,产物是( )| A. | NaOH、H2 | B. | Fe、NaCl | C. | Fe(OH)3、NaCl、H2 | D. | H2、NaCl、NaOH |
分析 钠投入到水中,钠先与水反应生成NaOH和氢气,NaOH再和氯化铁反应生成氢氧化铁沉淀,据此分析解答.
解答 解:Na投入到FeCl3溶液中,发生反应为:2Na+2H2O═2NaOH+H2↑,3NaOH+FeCl3═Fe(OH)3↓+3NaCl,则产物为Fe(OH)3、NaCl、H2,故选C.
点评 本题考查钠的性质,为高频考点,明确反应物质反应先后顺序是解本题关键,会运用化学语言描述反应现象,题目难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
17.下列化学方程式改写成离子方程式正确的是( )
| A. | 2NaOH+Cl2═NaCl+NaClO+H2O; Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | CaCO3+2HCl═CaCl2+CO2↑+H2O; CO32-+2H+═CO2↑+H2O | |
| C. | Al2(SO4)3+6NH3•H2O═2 Al(OH)3↓+3(NH4)2SO4;Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O; 2H++2OH-═2H2O |
3.X、Y、Z、W代表短周期的四种元素,有关它们的部分结构及性质信息如下表所示.
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答):
(1)X的气态氢化物分子的电子式是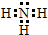 ;
;
(2)Z元素在周期表中的位置是第三周期ⅦA族;
(3)X、Y、Z三元素的最高价氧化物对应水化物的酸性,由强到弱的顺序是(用化学式表示)HClO4>HNO3>H2CO3;
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)写出Z的单质与二氧化硫的混合气体通入水中的离子反应方程式:Cl2+SO2+2H2O═4H++2Cl-+SO42-.
| 元素 | 部分结构信息 | 部分性质信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等; |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X的气态氢化物分子的电子式是
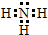 ;
;(2)Z元素在周期表中的位置是第三周期ⅦA族;
(3)X、Y、Z三元素的最高价氧化物对应水化物的酸性,由强到弱的顺序是(用化学式表示)HClO4>HNO3>H2CO3;
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)写出Z的单质与二氧化硫的混合气体通入水中的离子反应方程式:Cl2+SO2+2H2O═4H++2Cl-+SO42-.
7.下列溶液一定呈中性的是( )
| A. | pH=7的溶液 | |
| B. | c(H+)=c(OH-)=10-6mol/L溶液 | |
| C. | c(H+)═10-7mol/L | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
17.关于下列四个图象的说法正确的是( )
| A. | 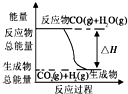 如图表示反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H>0 | |
| B. | 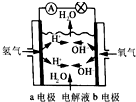 如图为氢氧燃料电池示意图,正、负极通入的气体体积之比为2:1 | |
| C. | 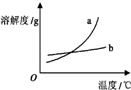 如图表示物质a、b的溶解度曲线,可以用重结晶方法从a、b混合物中提纯a | |
| D. |  如图可以表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,且乙的压强小 |
4.下列化学方程式或离子方程式正确的是( )
| A. | 用醋酸去除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 乙醛与新制Cu(OH)2浊液反应:NaOH+CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| C. | 实验室用液溴和苯在催化剂作用下制溴苯: +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$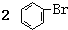 | |
| D. | 将CO2通入苯酚钠溶液: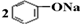 +CO2+H2O→ +CO2+H2O→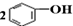 +Na2CO3 +Na2CO3 |
1.下列说法中错误的是( )
| A. | 质子数相同的原子,其核外电子排布也相同 | |
| B. | 质量数相同的不同原子,其化学性质一定相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
2.元素周期律的实质是( )
| A. | 相对原子质量逐渐增大 | B. | 核电荷数逐渐增大 | ||
| C. | 核外电子排布呈周期性变化 | D. | 元素化合价呈周期性变化 |
 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.
X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.