题目内容
6.下列离子方程式书写正确的是( )| A. | 澄清石灰水中加入盐酸:Ca(OH)2+2H+═2H2O+Ca2+ | |
| B. | 硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| C. | 碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 铁与氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |
分析 A.石灰水在离子反应中不能保留化学式;
B.不符合氢氧化钡和硫酸中离子的配比;
C.碳酸氢钙完全反应,生成碳酸钙、碳酸钠和水;
D.铁离子与铁反应生成亚铁离子.
解答 解:A.澄清石灰水中加入盐酸,氢氧化钙应该拆开,正确的离子反应为:OH-+H+=H2O,故A错误;
B.硫酸与氢氧化钡溶液反应的离子反应为:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,故B错误;
C.碳酸氢钙与过量的NaOH溶液反应,反应生成碳酸钙、碳酸钠和水,正确的离子反应为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故C错误;
D.铁与氯化铁溶液反应生成氯化亚铁,反应的离子方程式为:Fe+2Fe3+═3Fe2+,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,题目难度中等,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应及与量有关的离子反应考查.

练习册系列答案
相关题目
19.下列反应的离子方程式书写不正确的是( )
| A. | Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
17.下列化学方程式改写成离子方程式正确的是( )
| A. | 2NaOH+Cl2═NaCl+NaClO+H2O; Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | CaCO3+2HCl═CaCl2+CO2↑+H2O; CO32-+2H+═CO2↑+H2O | |
| C. | Al2(SO4)3+6NH3•H2O═2 Al(OH)3↓+3(NH4)2SO4;Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O; 2H++2OH-═2H2O |
14.F2、Cl2、Br2、I2的顺序,下列变化规律中不正确的是( )
a.单子颜色逐渐加深
b.密度呈增大趋势
c.熔点与沸点逐渐升高
d.X2的氧化性增强
e.HX稳定性减弱
f.X-还原性减弱
g.与H2反应逐渐困难
h.与水反应逐渐困难.
a.单子颜色逐渐加深
b.密度呈增大趋势
c.熔点与沸点逐渐升高
d.X2的氧化性增强
e.HX稳定性减弱
f.X-还原性减弱
g.与H2反应逐渐困难
h.与水反应逐渐困难.
| A. | ac | B. | be | C. | df | D. | gh |
1.下列说法中正确的是( )
| A. | 标准状况下,22.4L H2所含原子数目为NA | |
| B. | 1mol铁与足量盐酸反应,转3mol电子 | |
| C. | 1L0.5mol•L-1Al2(SO4)3溶液中,Al3+的浓度为1.0mol•L-1 | |
| D. | 1.8g NH4+所含的电子数目为NA |
11.下列对原子核外电子的描述不正确的是( )
| A. | 核外电子是分层排布的 | |
| B. | 在化学变化中,活泼金属元素容易失去电子形成阳离子,活泼非金属元素溶液得到电子形成阴离子 | |
| C. | 活泼金属或非金属元素通过电子得失形成离子时,最外层电子趋向于形成类似稀有气体原子的稳定结构 | |
| D. | 原子核外电子绕核做圆周运动 |
3.X、Y、Z、W代表短周期的四种元素,有关它们的部分结构及性质信息如下表所示.
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答):
(1)X的气态氢化物分子的电子式是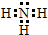 ;
;
(2)Z元素在周期表中的位置是第三周期ⅦA族;
(3)X、Y、Z三元素的最高价氧化物对应水化物的酸性,由强到弱的顺序是(用化学式表示)HClO4>HNO3>H2CO3;
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)写出Z的单质与二氧化硫的混合气体通入水中的离子反应方程式:Cl2+SO2+2H2O═4H++2Cl-+SO42-.
| 元素 | 部分结构信息 | 部分性质信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等; |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X的气态氢化物分子的电子式是
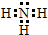 ;
;(2)Z元素在周期表中的位置是第三周期ⅦA族;
(3)X、Y、Z三元素的最高价氧化物对应水化物的酸性,由强到弱的顺序是(用化学式表示)HClO4>HNO3>H2CO3;
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(5)写出Z的单质与二氧化硫的混合气体通入水中的离子反应方程式:Cl2+SO2+2H2O═4H++2Cl-+SO42-.
1.下列说法中错误的是( )
| A. | 质子数相同的原子,其核外电子排布也相同 | |
| B. | 质量数相同的不同原子,其化学性质一定相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
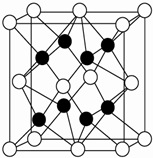 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.
X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.