题目内容
19.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,充电时,总反应为Na2Sx═2Na+xS(3<x<5),其反应原理如图所示,下列说法错误的是( )
| A. | 放电时,电极A为负极 | |
| B. | 该电池工作的适宜温度应控制10℃左右 | |
| C. | 放电时,内电路中Na+的移动方向为A到B | |
| D. | 充电时,阳极的电极反应式为 Sx2--2e-═xS |
分析 A、放电时,Na被氧化,应为原电池负极;
B、原电池工作时,控制的温度应为满足Na、S为熔融状态;
C、阳离子向正极移动;
D、充电时,是电解池反应,阳极反应为:Sx2--2e-=xS.
解答 解:A、放电时,Na被氧化,应为原电池负极,故A正确;
B、原电池工作时,控制的温度应为满足Na、S为熔融状态,则温度应高于10℃,故B错误;
C、阳离子向正极移动,即从A到B,故C正确;
D、充电时,是电解池反应,阳极反应为:Sx2--2e-=xS,故D正确;
故选B.
点评 本题考查了原电池知识,侧重于学生的分析能力的考查,注意把握原电池的工作原理以及电极方程式的书写,答题时注意体会,难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
9.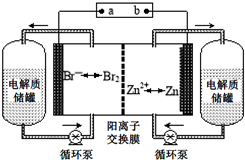 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 放电时左侧电解质储罐中的离子总浓度增大 | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 放电时负极的电极反应式为Zn-2e-═Zn2+ | |
| D. | 阳离子交换膜可阻止Br2与Zn直接发生反应 |
10.为实现实验目的,其它主要仪器、试剂及需要在某个部位放置温度计合理的是( )
| 选项 | 实验目的 | 玻璃实验仪器 | 实验试剂 | 温度计位置 |
| A | 制取乙烯 | 圆底烧瓶、集气瓶、导气管、酒精灯 | 浓硫酸、乙醇 | 反应液中 |
| B | 提纯乙醇 | 蒸馏烧瓶、冷凝管、锥形瓶、承接管 | 75%的乙醇 | 支气管口 |
| C | 中和热测定 | 烧杯、环形玻璃搅拌棒 | 氢氧化钠、醋酸 | 酸、碱及反应液中 |
| D | 制银镜 | 烧杯、试管、酒精灯 | 银氨溶液、葡萄糖 | 水浴的烧杯水中 |
| A. | A | B. | B | C. | C | D. | D |
14.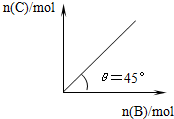 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
A(s)+2B(g)?4C(g)+D(g)△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
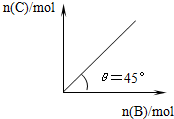 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
| A. | 若保持压强一定,当温度升高后,则图中θ>45° | |
| B. | 若再加入B,则正、逆反应速率均逐渐增大 | |
| C. | 平衡时B的转化率为50% | |
| D. | 若保持压强一定,再加入B,则平衡后反应体系气体密度减小 |
11.化学与生活密切相关,下列说法不正确的是( )
| A. | 饮用牛奶和豆浆可以缓解重金属引起的中毒 | |
| B. | 向煤中加入适量石灰石,可减少其燃烧产物中的SO2,降低对大气的污染 | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯 | |
| D. | 混凝法、中和法和沉淀法是污水处理中常用的化学方法 |
8.下列说法正确的是( )
| A. | 葡萄糖能水解成乙醇和二氧化碳 | |
| B. | 氨基乙酸、甲醛、乙二醇均可发生聚合反应 | |
| C. | 苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强 | |
| D. | 实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯 |
9.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| C. | 1L0.1mol•L-1的氨水中有0.1NA个N原子 | |
| D. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |

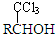 (-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾
(-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾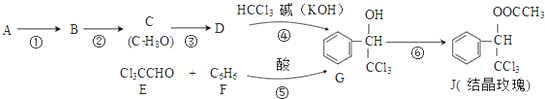
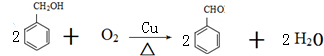 .
.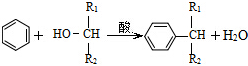 ,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.
,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.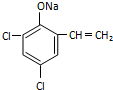 或
或 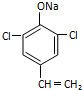 (只写一种).
(只写一种).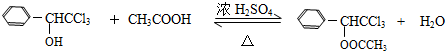 .
.