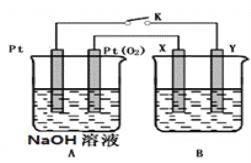
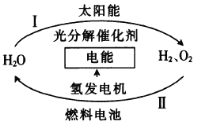
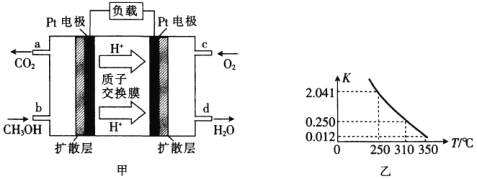
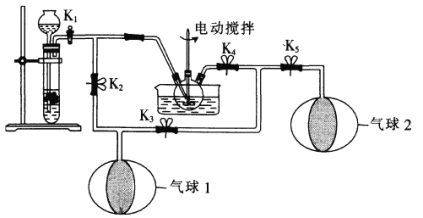
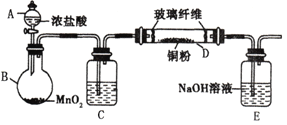
题目内容
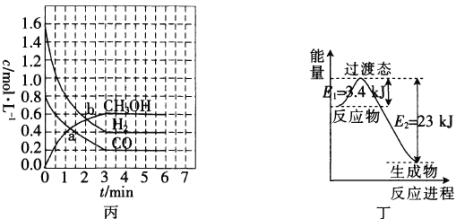
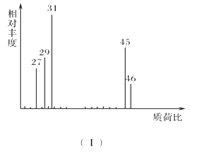
【题目】室温下,pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液至滴定终点,消耗NaOH溶液的体积为Vx、Vy,则

A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
【答案】C
【解析】
根据稀释相同倍数酸x、y的pH变化,判断强酸、弱酸,pH相等的强酸和弱酸与碱反应,反应中弱酸还继续电离,弱酸消耗碱的量大。
从图象看,稀释10倍,x的pH值变化1,y的pH值变化小于1,说明x为强酸,y为弱酸;体积相等、pH相等的强酸和弱酸与碱反应,反应中弱酸还继续电离,故弱酸消耗碱的量大,即Vx<Vy,综上所述,C项正确,
答案选C。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目