��Ŀ����
����Ŀ��I.���Ṥҵ�з�����Ϊ����������ɷ�ΪSiO2��Fe2O3��Al2O3��MaO��ijѧϰС���ͬѧ������·����������������н���Ԫ�ص���ȡʵ�顣

��֪����ҺpH=3.7ʱ��Fe3+�Ѿ�������ȫ��һˮ�ϰ��䱥����Һ��c(OH��)ԼΪ1��10-3mol��L-1��
��1��д��A������������Һ��Ӧ�����ӷ���ʽ��______________________________��
��2����������������ʹ���Լ��٣��Ʋ��Լ���Ӧ����____________������ĸ��
A���������ơ��� ��B������������ C����ˮ�������� D��ˮ
��3��H��������______________�����ѧʽ��
��4����ҺD������E��������Ҫ������ҺpH=13�����pH��С�����ܵ��µĺ����______________ ��
��4��������ҺF��c��Mg2+��=______________ ��25��ʱ��������þ��Ksp=5.6��10-12��
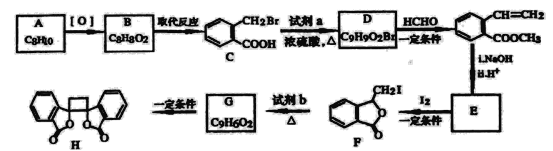
II.ij��ѧ��ȤС������ͼ��ʾװ�ý��е绯ѧԭ����ʵ��̽����
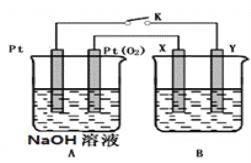
��1��Aװ��Ϊ�Ҵ�ȼ�ϵ�أ���X��Y����ͭ���������ҺΪNaOH��Һ����ع���һ��ʱ�䣬X����������ש��ɫ�������������ϵ�֪��Cu2O����д���õ缫�����ĵ缫��ӦʽΪ________________________��
��2����B��صĵ������ҺΪ500mL1.0mol/L��NaCl��Һ��X��Y��Ϊ���Ե缫������ع���һ��ʱ��Ͽ���ԴK��Y�缫��560mL����״������ɫ�������ɣ�����缫����������ȫ�������Һ������䣩��ʱB�����Һ��pH=____________��Ҫ�Ǹ���Һ�ָ���ԭ����״̬�������____________�������ʲ�ע�����ʵ�������
���𰸡�SiO2��2OH��=SiO32����H2O A NaHCO3��NaCl þ���ӳ�������ȫ�����������ܽⲻ��ȫ 5.6��10-10mol��L-1 2Cu-2e-+2OH-=Cu2O+H2O 13 ͨ0.05mol��HCl
��������
I����1���������еijɷ�SiO2��Fe2O3��Al2O3��MgO��SiO2Ϊ���������Fe2O3��MgOΪ���������Al2O3Ϊ����������ӹ����������AΪSiO2������A��NaOH��Һ��Ӧ�����ӷ���ʽΪSiO2��2OH��=SiO32����H2O��
��2������(1)�ķ�������ҺB�к��е�������Mg2����Al3����Fe3����H����Cl����������Ϣ����pH=3.7ʱ��Fe3��ȫ��ת��Ϊ�����������Լ��ٵ���pH=3.7����Ŀ������Fe3����Fe(OH)3��ʽ������������ҺD�м����Լ��٣�����pH=13��������Ϣ��һˮ�ϰ��䱥����Һ��c(OH��)ԼΪ1��10��3mol��L��1����pHΪ=11��˵�������Լ���Ϊǿ���A��ȷ��
��3�����ݣ�2���ķ�������ҺD�к��н�����������Mg2����Al3��������NaOH��Һ��pH=13����ʱAlԪ����AlO2����ʽ���ڣ�����EΪMg(OH)2������ҺF�к���ƫ�����ƺ��Ȼ��ƣ���F����Һ��ͨ�������CO2������AlO2����CO2��2H2O=Al(OH)3����HCO3��������ҺH�е�����ΪNaHCO3��NaCl��
��4����ǿ���������£���Ԫ����AlO2�����ڣ�þԪ����Mg(OH)2���ڣ�����Һ��pH=13ʱ����Һ��ǿ���ԣ����pH��С�����ܵ��µĺ����þ���ӳ�������ȫ�����������ܽⲻ��ȫ��
��5����ҺF��Mg(OH)2Ϊ������Һ����ʱ��Һ��pH=13����c(OH��)=10��1mol��L��1��c(Mg2��)=![]() =5.6��10��10mol��L��1��
=5.6��10��10mol��L��1��
II����1��X����������ש��ɫ��������ש��ɫ����ΪCu2O��˵���˵缫Cuʧȥ����ת����Cu2O����X�缫��ӦʽΪ2Cu��2e����2OH��=Cu2O��H2O��
��2������(1)�ķ�����X�缫Ϊ������YΪ������Y�缫�ķ�ӦʽΪ2H2O��2e��=H2����2OH����n(OH��)=2n(H2)=![]() ��2=0.05mol��c(OH��)=
��2=0.05mol��c(OH��)=![]() =0.1mol��L��1����pH=13��X�缫��ӦʽΪ2Cl����2e��=Cl2����������560mLH2ʱ������Cl2�����ʵ���Ϊ
=0.1mol��L��1����pH=13��X�缫��ӦʽΪ2Cl����2e��=Cl2����������560mLH2ʱ������Cl2�����ʵ���Ϊ![]() =0.025mol����NaCl��Һ��n(Cl��)=500��10��3L��1.0mol��L��1=0.5mol����Ȼ���ʳ��ˮ������ϵ�������������H2��Cl2����˻ָ���ԭ��״̬����Ҫͨ0.05mol��HCl��
=0.025mol����NaCl��Һ��n(Cl��)=500��10��3L��1.0mol��L��1=0.5mol����Ȼ���ʳ��ˮ������ϵ�������������H2��Cl2����˻ָ���ԭ��״̬����Ҫͨ0.05mol��HCl��

����Ŀ����2L�ܱ������м���һ�����Ĺ���A������B��������ӦA��s��+2B��g��![]() D��g��+E��g����H=QkJ��mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ����ʵ������:
D��g��+E��g����H=QkJ��mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ����ʵ������:
���ʵ�����mol�� ʱ�䣨min�� | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
��1��T��ʱ���÷�Ӧ��ƽ�ⳣ��K=___________��
��2��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬���ݱ��е������жϸı������������______������ĸ��ţ���
a.ͨ��һ������B
b.����һ�����Ĺ���A
c.�ʵ���С���������
d.���߷�Ӧ��ϵ�¶�
e.ͬʱ����0.2mol B��0.1molD��0.1mol E
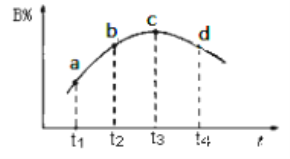
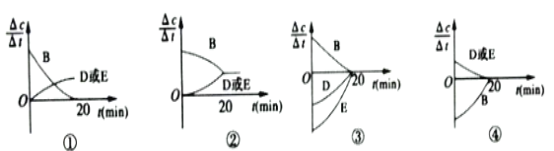
��3�����ڸ÷�Ӧ���ø����ʵķ�Ӧ������ʱ��Ĺ�ϵ���߱�ʾ���£�ʾ��ͼ�е�___________������ţ���ȷ��
��4��������������¶�T1�治�䣬��������м���1.60molB��0.20molD��0.20molE��0.4molA���ﵽƽ����������20����ʱ�����ʵ�Ũ����ȫ��ͬ��Ͷ�����A�����ʵ���n��ȡֵ��Χ��___________��
��5�������ܱ��������ȣ�ʵ����B��ת�������¶ȱ仯��ͼ��ʾ����ͼ��֪��Q_________0����������������С�ڣ���c��v��__________v������������������С������������������