题目内容
【题目】(1)甲醇一空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图甲所示,该电池中正极的电极反应式为_____。
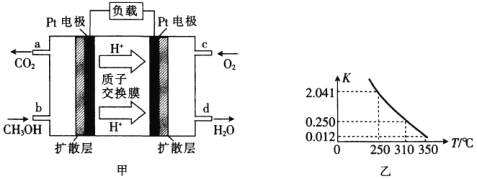
(2)工业上合成甲醇一般采用下列反应:![]() ,
,![]() ,图乙是该反应在不同温度下的化学平衡常数(K):
,图乙是该反应在不同温度下的化学平衡常数(K):
①由图中数据判断a_______0(填“>”“=”或“<”)。
②某温度下,将2molCO和6molH2充入2L的恒容密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为________℃。
(3)T℃时,在恒容密闭容器中发生反应:![]() ,各物质的浓度变化如图丙所示:
,各物质的浓度变化如图丙所示:
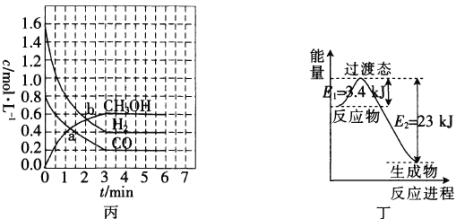
①反应从0min到3min之间,CH3OH的反应速率为________________。
②CO在0~1min和1~3min时平均反应速率[平均反应速率分别以v(0~1),v(1~3)表示]的大小为_____________________________。
(4)目前工业上有一种方法是用CO2和H2在230℃、催化剂条件下转化生成甲醇蒸气和水蒸气。图丁表示恒压容器中0.5molCO2和1.5molH2反应时转化率达80%的能量变化示意图。写出该反应的热化学方程式:_________________________________。
【答案】O2+4e-+4H+=2H2O < 310℃ 0.2mol/(L·min) > CO2+3H2=CH3OH+H2O H=-49kJ/mol
【解析】
(1)根据图像可知,正极上氧气得电子,与质子结合生成水;
(2)根据图像信息,确定K及温度的关系进行计算;
(3)①根据图像可知,0~3mim时甲醇的浓度变化为0.6mol/L;
②CO为反应物,开始浓度大,反应速率快,平均值也快,随反应的进行浓度逐渐减小,反应速率减慢,平均值降低;
(4)反应方程式为CO2+3H2=CH3OH+H2O,根据参加反应的二氧化碳的物质的量计算焓变。
(1)根据图像可知,正极上氧气得电子,与质子结合生成水,电极反应式为O2+4e-+4H+=2H2O;
(2)①根据图乙可知,升高温度,K减小,平衡逆向移动,则逆向反应为吸热反应,正方应放热,H<0;
② CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
初始(mol):2 6 0
反应(mol):1 2 1
平衡(mol):1 4 1
K=0.5/(22×0.5)=0.25,温度为310℃;
(3)①根据图像可知,0~3mim时甲醇的浓度变化为0.6mol/L,v(CH3OH)=0.6mol/L÷3min=0.2mol/(L·min);
②CO为反应物,开始浓度大,反应速率快,平均值也快,随反应的进行浓度逐渐减小,反应速率减慢,平均值降低,则v(0~1)>v(1~3);
(4)反应方程式为CO2+3H2=CH3OH+H2O,二氧化碳为0.5mol,转化率为80%,则参加反应的物质的量为0.4mol,释放的热量为23 kJ-3.4 kJ=19.6kJ,因此1mol时释放19.6kJ÷0.4=49kJ,则H=-49kJ/mol,因此该反应的热化学方程式为CO2+3H2=CH3OH+H2O H=-49kJ/mol。

【题目】向2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g)△H=QkJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)△H=QkJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
物质的量(mol) 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T℃时,该反应的平衡常数K=___________。
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是______(填字母编号)。
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2mol B、0.1molD、0.1mol E
(3)对于该反应,用各物质的反应速率与时间的关系曲线表示如下,示意图中的___________(填序号)正确。
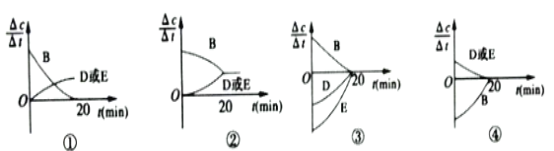
(4)容器的体积和温度T1℃不变,向该容器中加入1.60molB、0.20molD、0.20molE和0.4molA,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是___________。
(5)若该密闭容器绝热,实验测得B的转化率随温度变化如图所示。由图可知,Q_________0(填“大于”或“小于),c点v正__________v逆(填“大于”、“小于”或“等于”)。