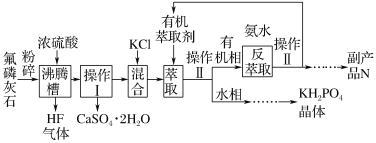
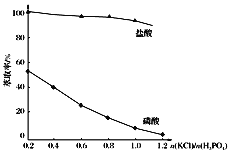
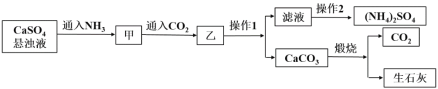
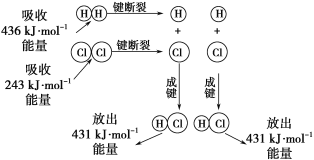
题目内容
【题目】实验室以MnO2、KClO3、CaCO3及盐酸等为原料制取KMnO4的步骤如下:
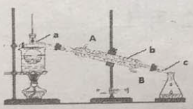
Ⅰ.MnO2的氧化![]()
Ⅱ.CO2的制取![]()
Ⅲ.K2MnO4的歧化及过滤和结晶等
回答下列问题:
(1)实验前称取2.5g KClO3、5.2g KOH、3.0g MnO2并充分混合。氯酸钾需过量,其原因是____________________________;熔融时除了需要酒精灯、三脚架、坩埚钳、细铁棒及铁坩埚外,还需要的硅酸盐质仪器有___________________
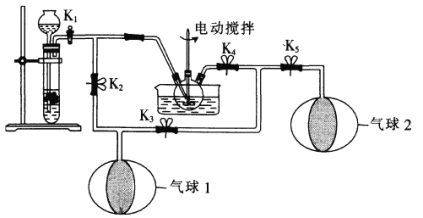
(2)为了体现“绿色化学”理念,某同学设计了如图所示的“K2MnO4歧化”实验装置。在大试管中装入块状CaCO3,并关闭K2,向长颈漏斗中加入一定量6mol·L-1的盐酸;向三口烧瓶中加入K2MnO4溶液。
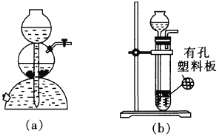
①实验时,不用装置(a)(启普发生器)制取CO2而用装置(b)制取,这是因为______。
②为了充分利用CO2,实验开始时需关闭____________(填“K1”“K2”“K3”“K4”或“K5”,下同),其余均打开;待“气球1”中收集到足够多的CO2时,关闭______,其余均打开。
③三口烧瓶中物质发生反应生成KMnO4的同时还会生成MnO2和K2CO3,该反应的离子方程式为______________________。
【答案】氯酸钾在二氧化锰、加热的条件下分解,并保证二氧化锰被充分氧化 泥三角 装置a中需要大量的盐酸,造成化学材料的浪费 K2、K5或K5 K1、K3 3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-
【解析】
(1)氯酸钾在二氧化锰、加热的条件下分解生成氯化钾等,为保证二氧化锰被充分氧化,则需要过量;把坩埚放置在三脚架时,需用泥三角;
(2)①装置a中需要大量的盐酸,造成化学材料的浪费,装置b为简易启普发生器,使用较少的盐酸;
②为了充分利用CO2,关闭K2、K5或K5阻止气体进入气球;待“气球1”中收集到足够多的CO2时,关闭K1、K3;
③三口烧瓶中二氧化碳与锰酸根离子反应生成高锰酸根离子、二氧化锰和碳酸根离子,离子方程式为:3MnO42-+2CO2=2MnO4-+MnO2+2CO32-。