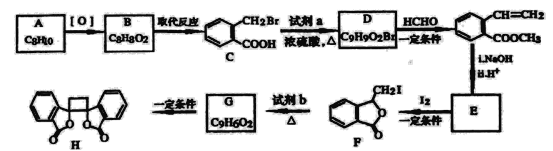
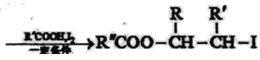题目内容
【题目】火箭的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉被氧化。放热引发高氯酸铵反应:2NH4ClO4═N2↑+4H2O+Cl2↑+2O2↑,反应放出大量热。
(1)该反应中被氧化的元素是___和___;
(2)氧化产物与还原产物的质量之比为___;
(3)该反应中若生成标况下2.24LCl2时,电子转移数为___;
(4)若生成的水在高温下也为气态,则混合气体的平均摩尔质量为__g/mol(小数点后保留一位)。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,易溶于水,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:___。
【答案】N O 92:71 1.4NA 29.4 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
【解析】
该反应中相关元素的化合价为:![]() ,反应过程中,N、O元素化合价升高,Cl元素化合价降低,
,反应过程中,N、O元素化合价升高,Cl元素化合价降低,
(1)该反应中,N、O元素化合价升高,因此被氧化的元素为N、O,
故答案为:N;O;
(2)由方程式可知,氧化产物为N2和O2,还原产物为Cl2,有2mol NH4ClO4发生反应时,生成的氧化产物为1mol N2和2molO2,还原产物1molCl2,故氧化产物与还原产物的质量之比为(1mol×28g/mol+2mol×32g/mol):(1mol×71g/mol)=92:71,
故答案为:92:71;
(3)该反应进行过程中,Cl元素化合价从+7价降低为0价,反应每生成1mol Cl2,转移电子(+7-0)×2mol=14mol,因此若生成标况下2.24LCl2,即0.1mol Cl2时,转移电子数为1.4mol×NAmol-1=1.4NA,
故答案为1.4NA;
(4)若生成的水在高温下也为气态,则混合气体的平均摩尔质量为= 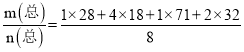 g/mol=29.4g/mol,
g/mol=29.4g/mol,
故答案为:29.4;
(5)由题干可知,反应后Fe元素化合价从+3价升高至+6价,变化3价,Cl元素从+1价降低至-1价,变化2价,根据氧化还原化合价升降守恒可知,Fe3+的系数为2,ClO-的系数为3,根据电荷守恒以及溶液为强碱性可配平离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案