题目内容
(16分)(1)已知:①N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
②4NH3(g)+5O2(g)= 4NO(g)+6H2O(g);△H="-905" kJ·mol-1
③2H2(g)十O2(g)=2H2O(g):△H=-483.6 kJ·mol-1
则N2(g)+3H2(g)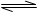 2NH3(g)的△H= 。
2NH3(g)的△H= 。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3)= ;②达到平衡时NH3的体积分数为 。
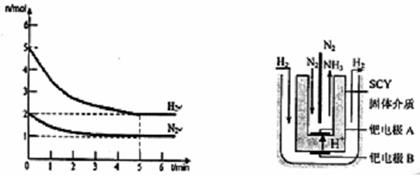
图1 图2 电解法合成氨装置
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 。
(4)草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C2O4、KHC2O4、K2C2O4 溶液的pH如下表所示。
①用离子方程式表示KHC2O4呈酸性的原因:
②取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2SO4溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
a.完成离子方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++ H2O。
b. 原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
②4NH3(g)+5O2(g)= 4NO(g)+6H2O(g);△H="-905" kJ·mol-1
③2H2(g)十O2(g)=2H2O(g):△H=-483.6 kJ·mol-1
则N2(g)+3H2(g)
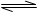 2NH3(g)的△H= 。
2NH3(g)的△H= 。(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3)= ;②达到平衡时NH3的体积分数为 。

图1 图2 电解法合成氨装置
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 。
(4)草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C2O4、KHC2O4、K2C2O4 溶液的pH如下表所示。
| | H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.0 | 3.1 | 8.1 |
②取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2SO4溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
a.完成离子方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++ H2O。
b. 原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
(1)-92.4kJ.mol-1 (2)①0.04mol?L-1?min-1 ②40%
(3)N2+6 e—+6H+=2NH3
(4)HC2O4--- H+ + C2O42--
H+ + C2O42--
a. 5 2 16 10 2 8 b. 1:3 (4分)
(3)N2+6 e—+6H+=2NH3
(4)HC2O4---
 H+ + C2O42--
H+ + C2O42--a. 5 2 16 10 2 8 b. 1:3 (4分)
(1)根据盖斯定律,将①-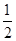 ②+
②+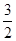 ③即可
③即可
(2)由所给数据可知:v(NH3)=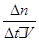 =
=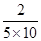 =0.04mol?L-1?min-1;平衡时N2、H2、NH3的物质的量分别为1mol、2mol、2mol,所以NH3的体积分类为40%
=0.04mol?L-1?min-1;平衡时N2、H2、NH3的物质的量分别为1mol、2mol、2mol,所以NH3的体积分类为40%
(3)由图示可知:在钯电极B上氢气失电子:3H2—6e—=6H+
钯电极A上得到NH3:N2+6 e—+6H+=2NH3
(4) ①KHC2O4为酸式盐,由于电离程度大于水解程度而呈酸性
②根据化合价升降守恒、电荷守恒、原子守恒配平即可
设每份儿溶液中含H2C2O4·2H2O、KHC2O4的物质的量分别为a mol、b mol
以酚酞为指示剂,终点时混合物均被中和为K2C2O4:2a+b=0.25×0.02
用KMnO4溶液滴定时,依方程式得到:a+b=0.1×0.016×5/2
得:a=" 0.001" mol b="0.003" mol
所以原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为1:3
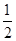 ②+
②+ ③即可
③即可(2)由所给数据可知:v(NH3)=
 =
= =0.04mol?L-1?min-1;平衡时N2、H2、NH3的物质的量分别为1mol、2mol、2mol,所以NH3的体积分类为40%
=0.04mol?L-1?min-1;平衡时N2、H2、NH3的物质的量分别为1mol、2mol、2mol,所以NH3的体积分类为40%(3)由图示可知:在钯电极B上氢气失电子:3H2—6e—=6H+
钯电极A上得到NH3:N2+6 e—+6H+=2NH3
(4) ①KHC2O4为酸式盐,由于电离程度大于水解程度而呈酸性
②根据化合价升降守恒、电荷守恒、原子守恒配平即可
设每份儿溶液中含H2C2O4·2H2O、KHC2O4的物质的量分别为a mol、b mol
以酚酞为指示剂,终点时混合物均被中和为K2C2O4:2a+b=0.25×0.02
用KMnO4溶液滴定时,依方程式得到:a+b=0.1×0.016×5/2
得:a=" 0.001" mol b="0.003" mol
所以原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为1:3

练习册系列答案
相关题目
 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0 CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75%
PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75% CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol




