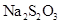题目内容
下列对于化学反应的研究结论正确的是
| A.已知常温常压下4Fe(s)+3O2(g)=2Fe2O3(s)是自发反应, 则该反应是吸热反应 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
C.一定条件下2molPCl3和2molCl2发生反应PCl3(g)+Cl2(g)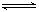 PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75% PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75% |
| D.用pH分别为2和3的醋酸中和等量的NaOH,消耗醋酸的体积分别为V1和V2,则V1>10V2 |
C
选项A中反应是熵值减小的,如果反应自发进行,则反应一定是放热反应,A不正确;选项B不正确,铅蓄电池放电时的负极和充电时的阳极均发生氧化反应;选项C中达平衡时放热139.5kJ,则消耗PCl3的物质的量是139.5kJ÷93kJ?mol—1=1.5mol,所以PCl3的转化率为1.5÷2=0.75,即转化率是75%,C正确;醋酸是弱酸,存在电离平衡,则pH分别为2和3的醋酸的浓度,则前者醋酸的浓度小于后者的10倍,因此中和等量的NaOH,消耗醋酸的体积分别为V1和V2,则V1<10V2,D不正确,答案选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目





 1/2N2O4(g) △H =-26.35 kJ·mol-1
1/2N2O4(g) △H =-26.35 kJ·mol-1
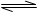 2NH3(g)的△H= 。
2NH3(g)的△H= 。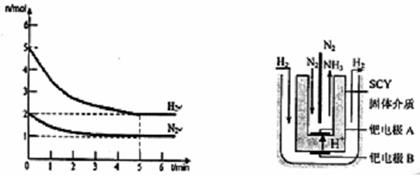
 H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
 1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1




 +SO2
+SO2