题目内容
(9分)丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g) +7O2(g) =" 6CO(g)" + 8H2O(l) △H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H2= -566kJ/mol
(1)写出表示丙烷气体燃烧热的热化学方程式
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g) CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
5min后体系达到平衡,经测定,H2为0.8mol,则υ(H2)= ,此过程吸收的热量为_______________________。
(3)对于反应CO(g) + H2O(g) CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
在一个绝热的固定容积的容器中,判断此反应达到平衡的标志是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥υ(CO2)正=υ(H2O)逆
已知:①2C3H8(g) +7O2(g) =" 6CO(g)" + 8H2O(l) △H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H2= -566kJ/mol
(1)写出表示丙烷气体燃烧热的热化学方程式
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g)
 CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol5min后体系达到平衡,经测定,H2为0.8mol,则υ(H2)= ,此过程吸收的热量为_______________________。
(3)对于反应CO(g) + H2O(g)
 CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol在一个绝热的固定容积的容器中,判断此反应达到平衡的标志是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥υ(CO2)正=υ(H2O)逆
(1)C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l) △H=-2219.9kJ/mol (3分)
(2)0.16mol/(L·min-1 )(2分), 32.96kJ(2分)
(3)①④⑤⑥(2分 少一得1分,少二0分,有错0分)
(2)0.16mol/(L·min-1 )(2分), 32.96kJ(2分)
(3)①④⑤⑥(2分 少一得1分,少二0分,有错0分)
(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据盖斯定律可知,(①+②×3)÷2即得到反应式C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l),所以该反应的反应热是△H=(-2741.8kJ/mol-566kJ/mol×3)=-2219.9kJ/mol。
(2)平衡时氢气的物质的量是0.8mol,则氢气的反应速率是υ(H2)=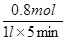 =0.16mol/(L·min-1 )。根据热化学方程式可知,反应过程中吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。
=0.16mol/(L·min-1 )。根据热化学方程式可知,反应过程中吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以④正确;由于容器是绝热的,所以在反应过程中,温度和压强都是变化的,因此选项①⑤是正确的;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,②不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是不变,所以③不能说明;⑥中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,所以可以说明,答案选①④⑤⑥。
(2)平衡时氢气的物质的量是0.8mol,则氢气的反应速率是υ(H2)=
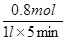 =0.16mol/(L·min-1 )。根据热化学方程式可知,反应过程中吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。
=0.16mol/(L·min-1 )。根据热化学方程式可知,反应过程中吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以④正确;由于容器是绝热的,所以在反应过程中,温度和压强都是变化的,因此选项①⑤是正确的;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,②不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是不变,所以③不能说明;⑥中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,所以可以说明,答案选①④⑤⑥。

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目




 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1

 2NH3(g)的△H= 。
2NH3(g)的△H= 。
 CH3CH2OH(g)+H2O(g) △H=—256.1kJ·mol—1。
CH3CH2OH(g)+H2O(g) △H=—256.1kJ·mol—1。 CO2(g)+H2(g) △H=—41.2kJ·mol—1
CO2(g)+H2(g) △H=—41.2kJ·mol—1
 CH3OH(g)
CH3OH(g) 中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。
中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。
 ②300℃时反应开始10分钟内,H2的平均反应速率为__________。
②300℃时反应开始10分钟内,H2的平均反应速率为__________。