题目内容
(12分)丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g) +7O2(g) =" 6CO(g)" + 8H2O(l) △H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H2= -566kJ/mol
(1)反应C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l)的△H=
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g) CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= ,此过程吸收的热量为________________________.
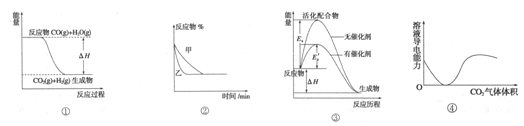
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
已知:①2C3H8(g) +7O2(g) =" 6CO(g)" + 8H2O(l) △H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H2= -566kJ/mol
(1)反应C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l)的△H=
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g)
 CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= ,此过程吸收的热量为________________________.
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
(1)-2219.9kJ/mol(2分) (2)0.16mol/L?min-1 (2分), 32.96kJ(2分)
(3)正(1分),负(1分), C3H8 + 10O2- -20e- =3CO2 +4H2O(2分)
(4)有无色气体生成,有白色沉淀生成。(2分)
(3)正(1分),负(1分), C3H8 + 10O2- -20e- =3CO2 +4H2O(2分)
(4)有无色气体生成,有白色沉淀生成。(2分)
(1)根据盖斯定律可知,(①+②×3)÷2,即得到C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l),所以反应热是△H=(-2741.8kJ/mol-566kJ/mol×3)÷2=-2219.9kJ/mol。
(2)反应速率通常用单位时间内浓度的变化量来表示,所以氢气的反应速率是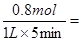 0.16mol/L?min-1 ;根据热化学方程式可知,吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。
0.16mol/L?min-1 ;根据热化学方程式可知,吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。
(3)原电池中阳离子向正极移动,阴离子向负极移动。负极失去电子,所以丙烷在负极通入,则负极方程式为C3H8 + 10O2- -20e- =3CO2 +4H2O。
(4)电解池中阴极是得到电子的,所以溶液中的氢离子在阴极放电生成氢气,从而破坏了阴极周围水的电离平衡,产生OH-,所以阴极还产生白色沉淀氢氧化镁。
(2)反应速率通常用单位时间内浓度的变化量来表示,所以氢气的反应速率是
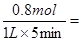 0.16mol/L?min-1 ;根据热化学方程式可知,吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。
0.16mol/L?min-1 ;根据热化学方程式可知,吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。(3)原电池中阳离子向正极移动,阴离子向负极移动。负极失去电子,所以丙烷在负极通入,则负极方程式为C3H8 + 10O2- -20e- =3CO2 +4H2O。
(4)电解池中阴极是得到电子的,所以溶液中的氢离子在阴极放电生成氢气,从而破坏了阴极周围水的电离平衡,产生OH-,所以阴极还产生白色沉淀氢氧化镁。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
 ,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大
,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1

 2NH3(g)的△H= 。
2NH3(g)的△H= 。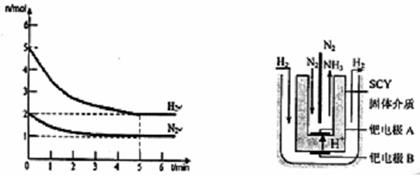
 CH3CH2OH(g)+H2O(g) △H=—256.1kJ·mol—1。
CH3CH2OH(g)+H2O(g) △H=—256.1kJ·mol—1。 CO2(g)+H2(g) △H=—41.2kJ·mol—1
CO2(g)+H2(g) △H=—41.2kJ·mol—1
 5C02 (g)+H2 (g)△H>0
5C02 (g)+H2 (g)△H>0