题目内容
13.下列说法中,正确的是( )| A. | 除去液溴中少量的氯水,可向其中加少量KI | |
| B. | 氯水和氯气均能使湿润的有色布条褪色,都是HClO作用的结果 | |
| C. | 某白色晶体与NaOH浓溶液混合,有能使湿润红色石蕊试纸变蓝的气体产生,则该晶体一定是NH4Cl | |
| D. | 某溶液能使淀粉碘化钾试纸变蓝,则溶液中一定含有Cl2 |
分析 A.氯气和溴都能和KI发生置换反应;
B.氯气没有漂白性,HClO有漂白性;
C.某白色晶体与NaOH浓溶液混合,有能使湿润红色石蕊试纸变蓝的气体产生,说明白色晶体中含有铵根离子,则该物质为铵盐;
D.能氧化碘化钾的物质不一定是氯气.
解答 解:A.氯气和溴都能和KI发生置换反应生成碘,引进新的杂质,应该用适量KBr除去氯水,故A错误;
B.氯气没有漂白性,HClO有漂白性,氯气和水反应生成HClO,所以氯水和氯气均能使湿润的有色布条褪色,都是HClO作用的结果,故B正确;
C.某白色晶体与NaOH浓溶液混合,有能使湿润红色石蕊试纸变蓝的气体产生,说明白色晶体中含有铵根离子,则该物质为铵盐,可能是氯化铵,故C错误;
D.双氧水也能氧化KI生成碘,碘遇淀粉试液变蓝色,故D错误;
故选B.
点评 本题考查除杂、物质检验、氧化还原反应等知识点,侧重考查学生分析判断能力,明确元素化合物知识是解本题关键,知道铵根离子检验方法及现象,易错选项是D.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
3. 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )
 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )| A. | -1 638 kJ/mol | B. | +1 638 kJ/mol | C. | -126 kJ/mol | D. | +126 kJ/mol |
4.甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.
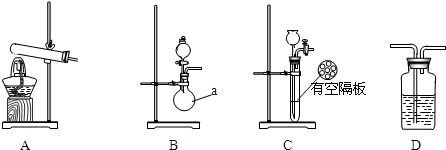
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L.
请回答下列问题:
(1)检查A装置气密性的操作是连接导管,将导管插入水中;加热试管,导管口有气泡产生;停止加热,导管内有水回流并形成一段稳定的水柱.
(2)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
(3)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为5V1:7(m1-m2).
(4)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.

甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L.
请回答下列问题:
(1)检查A装置气密性的操作是连接导管,将导管插入水中;加热试管,导管口有气泡产生;停止加热,导管内有水回流并形成一段稳定的水柱.
(2)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为① (NH4)2SO4+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaSO4. |
| 乙小组 | ②B | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆反应方向移动,加快氨气逸出. |
(4)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
8.元素在周期表中的位置反映了元素的性质.第3周期元素中,得电子能力最强的是( )
| A. | Na | B. | Si | C. | S | D. | Cl |
18.下列各组微粒具有相同的质子数和电子数的是( )
| A. | H2O、F- | B. | NH4+、Na? | C. | Mg2+、S2- | D. | HCl、H2S |
5.下列叙述正确的是( )
| A. | 无论是纯水还是酸性、碱性或中性稀溶液,常温下,其c(H+)•c(OH-)=1×10-14 | |
| B. | 某溶液由水电离出的c(OH-)=10-a mol/L,若a>7时,则该溶液的pH一定为14-a | |
| C. | 0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 任何浓度的溶液都可以用pH来表示其酸性的强弱 |