题目内容
18.下列各组微粒具有相同的质子数和电子数的是( )| A. | H2O、F- | B. | NH4+、Na? | C. | Mg2+、S2- | D. | HCl、H2S |
分析 根据原子的质子数相加即为微粒的质子数,阴离子中,电子数=质子数+电荷数,阳离子中,电子数=质子数-电荷数来分析解答.
解答 解:A.H2O、F-、的质子数分别为10、9,电子数分别为10、10,故A错误;
B.NH4+、NH2-的质子数分别为11、9,电子数分别为10、10,故B错误;
C.Mg2+、S2-的质子数分别为12、16,电子数分别为10、18,故C错误;
D.HCl、H2S的质子数都是18,电子数都是18,故D正确.
故选D.
点评 本题考查微粒的质子数和电子数,明确质子数和电子数的计算及中性微粒中质子数等于电子数是解答本题的关键,难度不大.

练习册系列答案
相关题目
8.下列各组化合物中,化学键类型有关叙述正确的是( )
| A. | CaCl2和Na2O2中都只含有离子键 | |
| B. | NaOH和NaHS都既含有离子键,又含有极性键 | |
| C. | CO2和H2S中都只含有非极性键 | |
| D. | H2O2和CS2都既含有极性键,又含有非极性键 |
9.甲苯分子被溴原子取代一个氢原子后,可能形成同分异构体数目是( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
6.将足量CO2通入下列溶液中,一定能产生沉淀的是( )
| A. | 硅酸钠溶液 | B. | 石灰水 | C. | 氯化钡溶液 | D. | 氯化钙溶液 |
13.下列说法中,正确的是( )
| A. | 除去液溴中少量的氯水,可向其中加少量KI | |
| B. | 氯水和氯气均能使湿润的有色布条褪色,都是HClO作用的结果 | |
| C. | 某白色晶体与NaOH浓溶液混合,有能使湿润红色石蕊试纸变蓝的气体产生,则该晶体一定是NH4Cl | |
| D. | 某溶液能使淀粉碘化钾试纸变蓝,则溶液中一定含有Cl2 |
3.用水稀释0.1mol•L-1氨水时,溶液中随水量的增加而减小的是( )
| A. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | C. | n(OH-)和c(H+) | D. | c(H+)和c(OH-)的乘积 |
10.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙.下列有关物质的推断不正确的是( )
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是NaOH溶液 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为NaOH溶液,则丁可能是CO2 |
7.如图为元素周期表截取的短周期的一部分,即 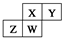 .四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
.四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
 .四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
.四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与最低负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
8.如果把Cu、Zn与稀H2SO4构成的原电池表示为Zn$\stackrel{H_{2}SO_{4}}{→}$Cu,则下列能表示原电池的是( )
| A. | Cu$\stackrel{H_{2}SO_{4}}{→}$Cu | B. | Cu$\stackrel{CuSO_{4}}{→}$Ag | C. | Zn$\stackrel{NH_{4}Cl}{→}$C | D. | Zn$\stackrel{C_{2}H_{5}OH}{→}$Cu |