题目内容
1.某芳香烃属于苯的同系物,10.6克该物质完全燃烧,产生的气体通过足量的澄清石灰水,生成80克白色沉淀,则此物质的同分异构体有( )| A. | 4种 | B. | 3种 | C. | 2种 | D. | 5种 |
分析 根据n=$\frac{m}{M}$设计成碳酸钙的物质的量,从而得出10.6g该有机物中含有的碳原子的物质的量;设该苯的同系物的分子式为CnH2n-6,分别根据C、总质量列式计算得出分子式,再结合分子式讨论其可能的结构简式.
解答 解:80g白色沉淀为碳酸钙,其物质的量为:$\frac{80g}{100g/mol}$=0.8mol,
设该苯的同系物的分子式为:CnH2n-6,
设该有机物的物质的量为x,根据该有机物的质量可得:①(14n-6)x=10.6,
根据碳原子守恒可得:②nx=0.8,
将②带入①可得:x=0.1mol,故n=8,
该有机物分子式为:C8H10,
分子式为C8H10的苯的同系物有: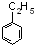 、
、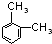 、
、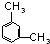 、
、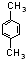 ,
,
总共有4种,
故选A.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确苯的同系物的通式及质量守恒定律为解答关键,注意掌握同分异构体的概念及书写原则.

练习册系列答案
相关题目
12.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因是当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO 4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因是当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
9.甲苯分子被溴原子取代一个氢原子后,可能形成同分异构体数目是( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
16.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s末H2的反应速率υ(H2)=0.3mol/(L•s),则3s末NH3的浓度为( )
| A. | 0.45 mol/L | B. | 0.6 mol/L | C. | 0.9 mol/L | D. | 1.2 mol/L |
6.将足量CO2通入下列溶液中,一定能产生沉淀的是( )
| A. | 硅酸钠溶液 | B. | 石灰水 | C. | 氯化钡溶液 | D. | 氯化钙溶液 |
13.下列说法中,正确的是( )
| A. | 除去液溴中少量的氯水,可向其中加少量KI | |
| B. | 氯水和氯气均能使湿润的有色布条褪色,都是HClO作用的结果 | |
| C. | 某白色晶体与NaOH浓溶液混合,有能使湿润红色石蕊试纸变蓝的气体产生,则该晶体一定是NH4Cl | |
| D. | 某溶液能使淀粉碘化钾试纸变蓝,则溶液中一定含有Cl2 |
10.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙.下列有关物质的推断不正确的是( )
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是NaOH溶液 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为NaOH溶液,则丁可能是CO2 |